
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Билет №24. Теория Льюиса не может дать количественную характеристику кислотно-основных взаимод
|
|
|
|
Теория Льюиса не может дать количественную характеристику кислотно-основных взаимод. Поскольку мерой кислотности по Льюису считается сродство к электрону, а эксп. Определить эту величину оень сложно.
Взаим-ие кислоты с основанием сводится к перераспределению между ними электронных пар.
К примеру протон является кислотой, поскольку ему не хватает электронов и требуется электронная пара для образования устойчивой электронной оболочки.
Аммиак является основанием, так как на атоме азота имеется неподелённая электронная пара.
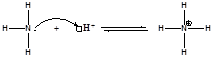
Наиболее широко используется теория Бренстеда.
Амфоте́рность (от др.-греч. (ἀμφότεροι — «двойственный», «обоюдный») — способность некоторых соединений проявлять в зависимости от условий как кислотные, так и осно́вные свойства.
Понятие амфоте́рность как характеристика двойственного поведения вещества было введено в 1814 г. Ж. Гей-Люссаком и Л. Тенаром. А. Ганч в рамках общей химической теории кислотно-основных взаимодействий (1917-1927 гг.) определил амфоте́рность как «способность некоторых соединений проявлять как кислотные, так и основные свойства в зависимости от условий и природы реагентов, участвующих в кислотно-основном взаимодействии, особенно в зависимости от свойств растворителя»[1].
Амфотерны гидроксиды таких элементов главных подгрупп, как бор, алюминий, галлий, мышьяк, сурьма, селен и др., таких элементов побочных подгрупп как хром, цинк, молибден, вольфрам и многих других. Обычно в химическом поведении гидроксидов преобладает или кислотный, или основный характер. отерность как химическое свойство вещества может проявляться по-разному:
1. В рамках теории электролитической диссоциации это способность вещества к электролитической диссоциации как по механизму кислот (с отщеплением ионов гидроксония, H+), так и по механизму оснований (отщепление гидроксид-ионов, OH–). Электролиты, которые в растворе ионизируются одновременно по кислотному и основному типам называются амфолитами Если обозначить амфотерный электролит формулой ROH, то его диссоциацию можно описать схемой:
H+ + RO–  ROH
ROH  R+ + OH–
R+ + OH–
2. В рамках протолитической теории Брёнстеда-Лоури проявление амфотерности рассматривается как способность протолита выступать донороми акцептором протона. Например, для воды амфотерность проявляется как автопротолиз[4]:
H 2 O + H 2 O  H 3 O + + OH -
H 3 O + + OH -
Амфолитами также будут вещества, имеющие в своём составе функциональные группы, способные быть донорами и акцепторами протонов. Например, к амфотерным органическим электролитам относятся белки, пептиды и аминокислоты. Так аминокислоты имеют в своём составе, по крайней мере, карбоксильную группу –COOH и аминогруппу –NH2. В растворе эти группы подвергаются частичной ионизации:
R–COOH + H2O  R–COO– + H3O+
R–COO– + H3O+
R–NH2 + H2O  R–NH3+ + OH-
R–NH3+ + OH-
Таким образом, молекула аминокислоты находится в двух равновесных формах, заряженной (цвиттер-ион) и незаряженной. В этих комбинациях R–COOH и R–NH3+ являются потенциальными кислотами (донорами протонов, катионов), а R–COO– и R–NH2 – сопряженными потенциальными основаниями (акцепторами протонов, катионов).3. Амфотерность может проявляться как способность вещества к взаимодействию как с кислотами, так и с основаниями. Это характерно для оксидов, гидроксидов и комплексных соединений некоторых p-элементов и большинства d-элементов в промежуточных степенях окисления. Амфотерность в той или иной степени является общим свойством гидроксидов[3]. Например, для соединений хрома (III) известны реакции[5]:
Cr(OH3) (тв) + 3HCl (р-р)  CrCl3 (р-р) + 3H2O
CrCl3 (р-р) + 3H2O
Cr(OH3) (тв) + NaOH (р-р) + 2H2O  Na[Cr(OH)4(H2O)2] (р-р)
Na[Cr(OH)4(H2O)2] (р-р)
Cr2O3 (тв) + 6HCl (р-р)  2CrCl3 (р-р) + 3H2O
2CrCl3 (р-р) + 3H2O
Cr2O3 (тв) + Na2CO3 (плавл)  2NaCrO2 + CO2 (газ)
2NaCrO2 + CO2 (газ)
Не соответствуют действительности традиционные представления о проявлении амфотерности гидроксидов как диссоциации по кислотному и основному типам[2]. В общем виде амфотерное поведение нерастворимых гидроксидов хрома (III), алюминия, цинка может описано как реакции ионного обмена ионов среды с лигандами H2O и OH–. Например, для Al(OH3) ионные равновесия могут быть записаны следующим образом:
[Al(OH)3(H2O)3] + 3H3O+  Al(H2O)63+ + 3H2O (в кислой среде)
Al(H2O)63+ + 3H2O (в кислой среде)
[Al(OH)3(H2O)3] + 3OH-  Al(OH)63-. (в щелочной среде)
Al(OH)63-. (в щелочной среде)
4. В ряде случаев важным косвенным признаком амфотерности является способность элемента образовывать два ряда солей, катионного и анионного типа[6]. Например, для цинка: ZnCl2, [Zn(H2O)4]SO4 (катионные) и Na2ZnO2, Na2(Zn(OH)4) (анионны
\
1. Электролиз - окислительно-восстановительный процесс протекающий на электродах при прохождении эл тока через расплав или раствор электролита. Сущность электролиза состоит в том, что за счет электрической энергии осуществляется ре акция, которая не может протекать самопроизвольно. Электролиз водных растворов электролитов- при рассмотрении электролиза водных растворов необходимо помнить, что кроме ионов электролита во всяком водном растворе есть еще ионы Н+ и ОН- - продукты диссоциации воды. В электрическом поле ионы Н+ перемещаются к катоду, а ионы ОН- к аноду. Таким образом, у катода могут разряжаться как катионы электролита, так и катионы водорода. У анода может происходить разряд как анионов электролита, так и гидроксид –ионов. Кроме того, молекулы воды также могут подвергаться электрохимическому окислению или восстановлению. Из нескольких возможных процессов будет протекать тот, осуществление которого сопряжено с минимальными затратами энергии. Электролиз расплавов - при электролизе расплавов в процессе учавствуют только ионы вещества, которое подвергается электролизу. Например, если подвергнуть электролизу расплав поваренной соли (NaCl), то на аноде будет выделяться тот же газ - хлор, а вот на катоде вместо водорода будет восстанавливаться чистый металл - натрий (Na). Именно таком способом в промышленности получают металлический натрий и другие щелочные и щелочноземельные металлы. Таким же образом получают другие щелочные металлы (калий (K), литий (Li), кальций (Ca)), проводя ток через расплавы их солей. Зако́ны электро́лиза Фараде́я являются количественными соотношениями, основанными на электрохимических исследованиях, опубликованных Майклом Фарадеем в 1834 году.[1] Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод. Под количеством электричества имеется в виду электрический заряд, измеряемый, как правило, в кулонах. Второй закон электролиза Фарадея: для данного количества электричества (электрического заряда) масса химического элемента, осаждённого на электроде, прямо пропорционально эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество. Законы Фарадея можно записать в виде следующей формулы:

Практическое применение электролиза Электролиз широко используется в различных отраслях промышленности. Остановимся на некоторых наиболее распространенных. Электролиз в металлургии. Электролизом растворов солей получают медь, цинк, кадмий, кобальт, марганец и другие металлы. Электролиз в химической промышленности. К наиболее крупному электролитическому процессу в промышленности относится электролиз раствора хлорида натрия с получением газообразных хлора на аноде, водорода на катоде и раствора щелочи в катодном пространстве. Получение гальванопокрытий. Гальваническими называются металлические покрытия, наносимые на поверхность какого-либо изделия методом электролиза. Электрохимическая обработка металлов и сплавов. Для изменения размеров и формы, а также состояния поверхности металлических изделий используют электрохимические методы обработки, при которых производится электроокисление металлических изделий: электрохимическая размерная обработка, анодирование и др. 2)Кинетическое уравнение реакций.Зависимость скорости реакции от температуры.Уравнение Аррениуса.Энергия активации.Реакционный механизм.Понятие о переходном комплексе и промежуточной частице.
Химическая кинетика – наука, изучающая протекание процессов во времени, т.е. скорости химических реакций, а также факторы, влияющие на скорость реакции и ее механизм.
Факторы, влияющие на скорость хим.реакции:
-природа реагирующих веществ
-концентрации реагирующих веществ
-температура
-катализаторы.


Рассматривая скорость как функции от концентрации получим:
Для реакции A2+B2↔2AB
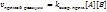

Закон действующих масс: скорость элементарной химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их стехиометрическим коэффициентам.
Для сложных реальных реакций закон действующих масс звучит следующим образом: скорость химической реакции прямо пропорциональна произведению реагирующих веществ в степенях некоторых чисел, определяющихся опытным путем.

Числа α и β называют порядком реакции по веществу, сумма этих чисел – общий порядок реакции.
Рассматривая скорость как функцию от температуры, получим эмпирическое правило Вант-Гоффа:
Скорость химической реакции возрастает в 2-4 раза при увеличении температуры на каждые 10 градусов.

Уравнение Аррениуса связывает две кинетические характеристики - константу скорости и энергию активации

Энергия активации – постоянная для реакции величина, минимальная энергия, которой должны обладать молекулы, чтобы их столкновение было эффективным.

При взаимодействии частиц происходит изменение их концентрации и образование промежуточного соединения системы, в котором связи в исходных веществах еще полностью не разорвались, а новые уже завязываются. Это переходное состояние системы и называется активированным комплексом. 3. Произведение растворимости Условия образования и ратсворения осадков. Ионный обмен и ионообменники.
Насыщенный раствор образуется в том случае, когда растворяемое вещ-во больше уже не может растворяться в нем.Если растворяемое вещ-во представляет собой ионное соединение, то ионы в насыщенном растворе находятся в динамическом равновесии с избыточным, нерастворившимся тв вещ-вом. Например, в насыщенном растворе хлорида серебра устанавливается следующее равновесие: AgCl(тв)=Ag+(водн)+Cl-(водн)
Константа этого равновесия определяется выражением: Kпр=([Ag+][Cl-])равн
K-произведение растворимости хлорида серебра.Растворимость хлорида серебра можно выразить через концентрацию с растворенного AgCl в воде.Эта концентрация совпадает с конц обоих ионов в растворe [Ag]=[Cl]=c
Кпр=с 2
В насыщенном растворе электролита произведение концентраций его ионов есть величина постоянная при данной температуре.Эта величина количественно характеризует способность электролита растворяться.
Условие образования и растворения осадков: произведение растворимостей могут использоваться для предсказания условий осаждения солей из раствора.Если произведение концентраций ионов в двух смешиваемых растворах превосходит произведение растворимости, то после смешивания раствора будет происходить осаждение осадка, до тех пор, пока произведение концентраций ионов не станет меньше произведения растворимости.
Ионный обмен-это процесс, в результате которого ионы, находящиеся в твердой фазе,обмениваются с ионами, находящимися в растворе.
Ионообменники: катионообменники, анионообменники.Когда твердый катионообменник приходит в соприкосновение с раствором, в котором содержатся какие-либо ионы, между ними устанавливается равновесие.
Ионный материал можно регенерировать(восстанавливать)
Анионообменник удаляет из раствора анионы.Для регенерации анионообменника может использоваться какое-либо основание.
|
|
|
|
|
Дата добавления: 2015-04-23; Просмотров: 466; Нарушение авторских прав?; Мы поможем в написании вашей работы!