
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия. 2 закон термодинамики. 3 закон термодинамики. 1.Развитие представлений о строении атома
|
|
|
|
Билет 10
Овр
1.Развитие представлений о строении атома. Составные части атома – ядро (протоны, нейтроны), электроны, их заряд и масса.
Атом – наименьшая (неделимая химическим путем) часть элемента, сохраняющая все свойства, определенные зарядом ядра и электронной оболочкой. Атомный номер Z равен числу протонов в атомном ядре. В электронной оболочке электронейтрального атома содержится Z электронов. Массовое число A равно числу протонов Z и числу нейтронов N в атомном ядре; A = Z + N.
Нейтроны и протоны – элементарные частицы, имеющие массу ок 1 аем. Протоны - положительно заряженные микрочастицы с массой. 1 а.е.м и зарядом 1,6*10-19 Кл., условно принятым за единицу положительного заряда. Нейтроны - нейтральные частицы с массой 1 а.е.м. История:
V в до н.э. – Демокрит вводит понятие атом-неделимый.
1896-Беккеркль открывает радиоактивность.
1897- Томсон – электрон. 1903- модель атома Томсона. «однородный шар из +заряженного вещества, в кот. Находятся электроны.
1911- Модель атома Резерфорда. Идея опыта: наблюдать отклонения заряженных частиц, пролетающих мимо атома. Результат: 1.Большинство частиц не отклоняются. 2.Небольшое кол-во частиц(1 из 20000) резко откл. назад. Объяснение: 1.В атоме много пустоты. 2.+заряд сосредоточен в объеме намного меньше объема атома. Вывод: Планетарная модель. Атом состоит из ядра и эл. оболочки. В центре атома находится положительно заряженное ядро, занимающее ничтожно малый объем атома. Весь положительный и вся масса атома сосредоточены в ядре.Заряд соостветствует кол-ву протонов в ядре и соостветствует порядковому номеру в таблице Менделеева и кол-ву электронов в атоме. Вокруг ядра вращаются электроны и их число равняется "+" заряду ядра. Однако такой атом не может быть устойчивым. Электроны не должны терять энергию, излучая ее, и упасть на ядро. В действительности электронные оболочки всех атомов устойчивы.
Энтропия (S) – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы. Больцман определил энтропию как термодинамическую вероятность состояния (беспорядок) системы W. Размерность энтропии 1 моля вещества совпадает с размерностью газовой постоянной R и равна Дж∙моль–1∙K–1. Изменение энтропии в необратимых и обратимых процессах передается соотношениями ΔS > Q / T и ΔS = Q / T. Например, изменение энтропии плавления равно теплоте (энтальпии) плавления ΔSпл = ΔHпл/Tпл Для химической реакции изменение энтропии аналогично изменению энтальпии. Энтропия вещества или системы тел при определенной температуре является абсолютной величиной. Энтропия зависит от:
1. Агрегатного состояния вещества. Энтропия увеличивается при переходе от твердого к жидкому и особенно к газообразному состоянию (вода, лед, пар).
2. Изотопного состава (H2O и D2O).
3. Молекулярной массы однотипных соединений (CH4, C2H6, н-C4H10).
4. Строения молекулы (н-C4H10, изо-C4H10).
5. Кристаллической структуры (аллотропии) – алмаз, графит.
стремление системы к беспорядку проявляется тем больше, чем выше температура. Произведение изменения энтропии системы на температуру TΔS количественно оценивает эту тенденцию и называется энтропийным фактором. S возрастает при переходе в-ва из кристаллического состояния в жидкое и из жидкого в газообразное, при растворении кристаллов, при расширении газов, при хим.взаимодействиях, приводящих к увеличению числа частиц, и прежде всего частиц в газообразном состоянии. Напротив, все процессы в результате которых упорядоченность системы возрастает(конденсация, полимеризация, сжатие, уменьшения числа частиц), сопровождаются уменьшением энтропии.
В изолированных системах энтропия самопроизвольно протекающего процесса увеличивается ΔS > 0 (второй закон термодинамики).
Энтропия равна нулю только у идеального кристалла при абсолютном нуле (третий закон термодинамики).
3. Электролиз. Электролиз водных растворов и расплавов. Законы Фарадея. Практическое применение элеткролиза.
Электролиз - окислительно-восстановительный процесс протекающий на электродах при прохождении эл тока через расплав или раствор электролита.
Сущность электролиза состоит в том, что за счет эл энергии осуществляется реакция, которая не может протекать самопроизвольно.
ФАРАДЕЯ ЗАКОНЫ, основные законы электролиза, отражающие общий закон сохранения в-ва в условиях протекания злектрохим. р-ции. Установлены M. Фарадеем в 1833-34. Согласно 1-му закону, масса в-ва т, прореагировавшего в процессе электролиза, прямо пропорциональна силе тока I и времени электролиза t, т. е. кол-ву пропущенного электричества Q = It. Согласно 2-му закону, для разных электродных процессов при одинаковом кол-ве пропущенного электричества Q массы прореагировавших в-в относятся друг к другу так же, как молярные массы эквивалентов этих в-в. Оба Ф. з. объединяются одним ур-нием:
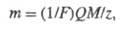
где Mz - мол. м. эквивалента в-ва, участвующего в электролизе. F - Фарадея постоянная, равная 96500 Кл/моль.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 517; Нарушение авторских прав?; Мы поможем в написании вашей работы!