
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Принцип Паули и распределение электронов по энергетическим уровням атома
|
|
|
|
В. Паули установил (1925) квантово-механический закон, называемый принципом Паули или принципом исключения:
в любом атоме не может быть двух электронов, находящихся в двух одинаковых стационарных состояниях, определяемых набором четырех квантовых чисел: главного п, орбитального l, магнитного т и спинового ms.
Применительно к системе электронов в атоме принцип Паули можно записать следующим образом:

где Z1 (п, l, т, ms) — число электронов, находящихся в состоянии, описываемом набором квантовых чисел n, l, т и ms. Пользуясь принципом Паули, можно найти максимальное число электронов в атоме, имеющих заданные значения трех (п, l, т), двух (n, l) и одного (п) квантовых чисел. Найдем максимальное число Z2{n, l, m) электронов, находящихся в состояниях, определяемых набором трех квантовых чисел  , т. е. отличающихся лишь ориентацией спинов электронов. Так как число ms может принимать лишь два значения, т. е.
, т. е. отличающихся лишь ориентацией спинов электронов. Так как число ms может принимать лишь два значения, т. е.  и
и  то, очевидно, имеем
то, очевидно, имеем
 .
.
Слой, 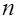
| Число электронов в состояниях | Максимальное число электронов | ||||
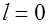 , , 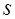
| 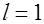 , , 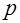
| 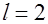 , , 
| 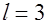 , , 
|  , , 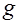
| ||
 , ,  
| 
| 
| ||||
 , , 
| 
| 
| 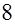
| |||
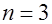 , , 
| 
| 
| 
| 
| ||
 , , 
| 
| 
| 
| 
| 
| |
 , , 
| 
| 
| 
| 
| 
| 
|
31. Периодическая система элементов.:
1) порядковый номер химического элемента равен общему числу электронов в атоме данного
элемента;
2) состояние электронов в атоме определяется набором их квантовых чисел 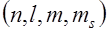 . Распределение электронов в атоме по энергетическим состояниям должно удовлетворять принципу минимума потенциальной энергии: с возрастанием числа электронов каждый следующий электрон
. Распределение электронов в атоме по энергетическим состояниям должно удовлетворять принципу минимума потенциальной энергии: с возрастанием числа электронов каждый следующий электрон
должен занять возможное энергетическое со стояние с наименьшей энергией;
3) заполнение электронами энергетических состояний в атоме должно происходить в соответствии с принципом Паули
Химические свойства элементов и ряд их физических свойств объясняются поведением внешних, валентных, электронов их атомов. Поэтому периодичность свойств химических элементов должна быть связана с определенной периодичностью в расположении электронов в атомах различных элементов.
Электроны в атоме, занимающие совокупность состояний с одинаковым значением главного квантового числа п, образуют электронный слой. В зависимости от значений п различают следующие слои: К при  , L при
, L при  , М при
, М при 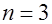 , N при
, N при  , О при
, О при  и т. д.
и т. д.
Максимальное число электронов, которые могут находиться в слоях: в К-слое — 2 электрона, в слоях L, М, N и О — соответственно 8, 18, 32 и 50 электронов.
В каждом из слоев электроны распределяются по оболочкам, каждая из которых соответствует определенному значению орбитального квантового числа 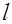 .
.
В атомной физике принято обозначать электронное состояние в атоме символом 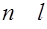 , указывающим значения двух квантовых чисел. Электроны, находящиеся в состояниях, характеризуемых одинаковыми квантовыми числами п и
, указывающим значения двух квантовых чисел. Электроны, находящиеся в состояниях, характеризуемых одинаковыми квантовыми числами п и 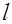 , называются эквивалентными. Число z эквивалентных электронов указывается "показателем степени в символе
, называются эквивалентными. Число z эквивалентных электронов указывается "показателем степени в символе  . Если электроны находятся в некоторых состояниях с определенными значениями квантовых чисел п и
. Если электроны находятся в некоторых состояниях с определенными значениями квантовых чисел п и 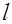 , то считается заданной электронная конфигурация. Например, основное состояние атома кислорода можно выразить следующей символической формулой:
, то считается заданной электронная конфигурация. Например, основное состояние атома кислорода можно выразить следующей символической формулой:
1s2, 2s2, 2p4.
Она показывает, что два электрона находятся в состояниях с  ,
, 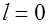 два электрона имеют квантовые числа
два электрона имеют квантовые числа  и
и 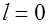 и четыре электрона занимают состояния с
и четыре электрона занимают состояния с  и
и 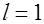 .
.
Химические свойства элементов и ряд их физических свойств объясняются поведением внешних, валентных, электронов их атомов. Поэтому периодичность свойств химических элементов должна быть связана с определенной периодичностью в расположении электронов в атомах различных элементов.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 2164; Нарушение авторских прав?; Мы поможем в написании вашей работы!