
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Устройство и назначение водородного электрода. Измерение стандартных электродных потенциалов металлов. Ряд напряжений металлов
|
|
|
|
Ответ: Устройство и назначение водородного электрода: Абсолютное значение электрического потенциала металла измерить не возможно, поэтому их измеряют сравнивая с другим таким же электрическим потенциалом, величина которого условно принимается за 0. Таким электрическим – эталоном является стандартный водородный электрон. 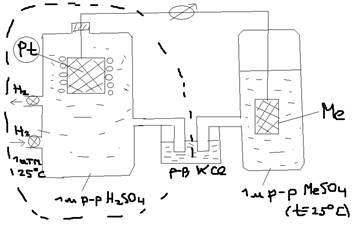 В стан. водный электролит представляет собой плат. пластину накрытую рыхлым слоем мелко раздробленной плотины и погруженную в одномолярный раствор серной кислоты (H2SO4) через который пропускается ток водорода, водород в громадном количестве поглощается платиной в результате чего он уподобляется как бы сделаным из твёрдого водорода. В поверхностном слое при каталическом действии плотины часть молекул водорода диссоциируют на атомы: H2<->2H а на границе электролита раствор кислоты возникает равновесный: H<->H++e- (подобно (1)). То есть возникает разность потенциалов, величина которого условно принимается за 0. Измерение EO Me/Men+. Для измерения EO металла – составляется цепь, в которой: одним электроном является стандартный электрон водорода, а другим – изучаемый металл, погруженный в одномолярный раствор своей соли (t=25 OC). По показанию гальванометра
В стан. водный электролит представляет собой плат. пластину накрытую рыхлым слоем мелко раздробленной плотины и погруженную в одномолярный раствор серной кислоты (H2SO4) через который пропускается ток водорода, водород в громадном количестве поглощается платиной в результате чего он уподобляется как бы сделаным из твёрдого водорода. В поверхностном слое при каталическом действии плотины часть молекул водорода диссоциируют на атомы: H2<->2H а на границе электролита раствор кислоты возникает равновесный: H<->H++e- (подобно (1)). То есть возникает разность потенциалов, величина которого условно принимается за 0. Измерение EO Me/Men+. Для измерения EO металла – составляется цепь, в которой: одним электроном является стандартный электрон водорода, а другим – изучаемый металл, погруженный в одномолярный раствор своей соли (t=25 OC). По показанию гальванометра  судят о величине EO данного металла.
судят о величине EO данного металла.
Электрохимический ряд напряжений: По химически активный в растворе Me расположенным в ряду называют рядом напряжений:  Свойство ряда напряжений: 1)Чем меньше алгебраическая величина EO, тем больше способность Me, погружаться в раствор, отдавать свои электроны то есть чем выше химически активен Me. Самый активный (Li: -3,02) он легче других Me отдаёт электроны, но труднее всех принимает электроны, то есть это самый сильный восстановитель. Самый мало активный – золото (Au=1,50) он труднее всех металлов отдаёт электроны, но легче всех их принимает, самый сильный окислитель. Кан. Металлы (не рахлагают воду) вытесняю из раствора солей те металлы, которые стоят после его в ряду напряжений, то есть имеет большую алгебраическую величину EO. Водородн из раствора кислот (крое HNO3) может быть вытеснен (восстановлен) только теми металлами, которые стоят до него в ряде напряжений, то есть имеют отрицательное значение EO. Уравнение Нернста – это уравнение применимое для определение электрического потенциала металлов погруженных в раствор своих солей, концентраций которых отличается от одномолярных.
Свойство ряда напряжений: 1)Чем меньше алгебраическая величина EO, тем больше способность Me, погружаться в раствор, отдавать свои электроны то есть чем выше химически активен Me. Самый активный (Li: -3,02) он легче других Me отдаёт электроны, но труднее всех принимает электроны, то есть это самый сильный восстановитель. Самый мало активный – золото (Au=1,50) он труднее всех металлов отдаёт электроны, но легче всех их принимает, самый сильный окислитель. Кан. Металлы (не рахлагают воду) вытесняю из раствора солей те металлы, которые стоят после его в ряду напряжений, то есть имеет большую алгебраическую величину EO. Водородн из раствора кислот (крое HNO3) может быть вытеснен (восстановлен) только теми металлами, которые стоят до него в ряде напряжений, то есть имеют отрицательное значение EO. Уравнение Нернста – это уравнение применимое для определение электрического потенциала металлов погруженных в раствор своих солей, концентраций которых отличается от одномолярных. 
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 962; Нарушение авторских прав?; Мы поможем в написании вашей работы!