
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электродные потенциалы. Механизм возникновения. Зависимость потенциалов от природы электролитов и растворителей
|
|
|
|
Ответ: Химические процессы сопровождающиеся появлением электрического тока или процессы вызываемые подведением из вне электрической энергии – называются – электрохимическими. Получение электрическое энергии за счёт химических реакций – проиcходит в гальванических элементах. Возникновение химических реакций за счёт затраченной электроэнергии происходит – при электролизе. Отличия химического процесса от электро-химического процесса: а)в химическом процессе химическая энергия превращается в тепловую энергию; б)в электрическом процессе химическая энергия превращается в электрическую энергию.
Электродные потенциалы. Механизм возникновения: Как известно любые металлы можно представить как равновесную систему состоящую из нейтральных атомов, катионов и ионов. Если какой-либо металли привести в контакт с водой: 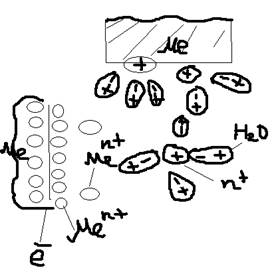 Погрузим металлическую пластину в воду. Полярные молекулы воды вступают во взаимодействие с катионами (Me+n), в результате чего катионы металлов (n+) будут отторгнуты от кристаллической решётки, и перейдут в раствор. Часть перешедших в раствор катионов (металлы n+) в непосредственной близости от металла создают положительный электрический заряд, то есть заряженный раствор положительно, остальные в металле электроны создают отрицательный заряд. Таким образом на границе металлы-вода образуется двойной электрический слой, то есть возникает разность потенциалов, которая называется – электрическим потенциалом металла (E Me/Men+). Концентрация катинов Men+ очень мала и быстро наступает равновесие:
Погрузим металлическую пластину в воду. Полярные молекулы воды вступают во взаимодействие с катионами (Me+n), в результате чего катионы металлов (n+) будут отторгнуты от кристаллической решётки, и перейдут в раствор. Часть перешедших в раствор катионов (металлы n+) в непосредственной близости от металла создают положительный электрический заряд, то есть заряженный раствор положительно, остальные в металле электроны создают отрицательный заряд. Таким образом на границе металлы-вода образуется двойной электрический слой, то есть возникает разность потенциалов, которая называется – электрическим потенциалом металла (E Me/Men+). Концентрация катинов Men+ очень мала и быстро наступает равновесие: 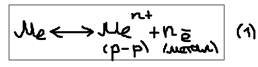 Если добавить в воду дополнительно катионы Men+ в виде его растворителей соли:
Если добавить в воду дополнительно катионы Men+ в виде его растворителей соли: 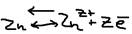 , то равновесие смещается влево, то есть эти избыточные катионы Men+, будут принимать с металла электроны и восстанавливаться, в результате число электронов на пластине уменьшится. Таким образом отрицательный заряд пластины тем меньше, чем больше концентрация ионов металла в растворе. Значит при увеличении концентрации ионов Men+ смещение равновесие на 1, может привести к тому, что пластину преобразует даже положительный заряд (за счёт внедрения в кристаллическую решётку металла ионов растворителей соли, раствор при этом заряжен отрицательно, за счёт избытков анионов соли. И снова появляется двойной электрической слой, то есть разность потенциалов (но металлы при этом заряжены положительно,а раствор – отрицательно). Такая ситуация характерна для малоактивных Me (Cu). Активные же металлы (Zn) при любой концентрации раствора остаются отрицательно заряженными.
, то равновесие смещается влево, то есть эти избыточные катионы Men+, будут принимать с металла электроны и восстанавливаться, в результате число электронов на пластине уменьшится. Таким образом отрицательный заряд пластины тем меньше, чем больше концентрация ионов металла в растворе. Значит при увеличении концентрации ионов Men+ смещение равновесие на 1, может привести к тому, что пластину преобразует даже положительный заряд (за счёт внедрения в кристаллическую решётку металла ионов растворителей соли, раствор при этом заряжен отрицательно, за счёт избытков анионов соли. И снова появляется двойной электрической слой, то есть разность потенциалов (но металлы при этом заряжены положительно,а раствор – отрицательно). Такая ситуация характерна для малоактивных Me (Cu). Активные же металлы (Zn) при любой концентрации раствора остаются отрицательно заряженными. 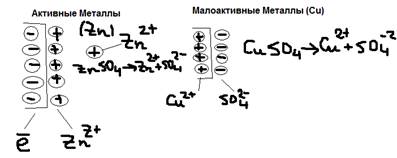 Если металлы погружены в одном растворе с солью при температуре 25 OС, то образуется электрический потенциал, который называется стандартным электрическим потенциалом и обозначается: EO Me/Men+.
Если металлы погружены в одном растворе с солью при температуре 25 OС, то образуется электрический потенциал, который называется стандартным электрическим потенциалом и обозначается: EO Me/Men+.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 957; Нарушение авторских прав?; Мы поможем в написании вашей работы!