
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Водные растворы электролитов. Особенности растворов кислот, солей, оснований. Теория электролитической диссоциации
|
|
|
|
Ответ: Однако имеются вещества растворы которых не подчиняются законом Рауля и Вант-Гоффа. Это кислоты, основания и соли, их особенности: 1)они проводят электрический ток только будучи растворителем или расплавленными, поэтому их называют электролитами. 2)для их раствора: 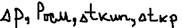 всегда больше чем это овтечает концентратору раствора (для не электролитов). Для того, чтобы распространить законы Рауля и Вант-Гоффа на рост этих веществ Вант-Гофф ввёл поправочный коэффициент I (изотонический коэффициент или коэффициент Вант-Гоффа).
всегда больше чем это овтечает концентратору раствора (для не электролитов). Для того, чтобы распространить законы Рауля и Вант-Гоффа на рост этих веществ Вант-Гофф ввёл поправочный коэффициент I (изотонический коэффициент или коэффициент Вант-Гоффа). 
Основы теории электролитической диссоциации: Без водной соли кислота, основание – электрический ток не проводят. Почти не проводит ток и чистая вода. Очевидно, что при растворении в воде подобные вещества подвергаются каким-то изменениям, которые обуславливают электропроводность полученного раствора. Аррениус в 1887г. Придумал теории электролитической диссоциации: Молекулы электролита в воде или других полярных растворителях распадаются, диссоциируют на положительно и отрицательно заряженные ионы, это явление он назвал электролитической диссоциацией. Положительно заряженные ионы – катионы: K+ (H+; Na+…). Отрицательно заряженные ионы – анионы A- (OH-; Cl-…). Растворы и расплавленные электролиты относительно к проводникам второго рода, электролиты которые обуславливают наличие: K+, A-. Однако теории Аррениуса исключает: возможность химического взаимодействия ионов с молекулами раствора, поэтому она не могла объяснить причину диссоциации, её движущую силу. Теория Аррениуса противоречит химической теории Менделеева в основе которой лежало представление, только о химическом взаимодействии молекулярных растворителей вещества с молекулярным раствором. Это кажущееся противоречие преодолел И.А. Каблуков который выдвинул теорию сольватации ионов. Сольватация – это взаимодействие ионов электрически с полярными молекулами электролита. (Если растворитель вода то процесс называется – гидротацией). I – показывает во сколько раз увеличивается число частиц в растворе в результате происхождения полной или неполной ионизации вещества. 
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1098; Нарушение авторских прав?; Мы поможем в написании вашей работы!