
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Степень диссоциации. Виды электролитов. Константа диссоциации слабых электролитов
|
|
|
|
Ответ: Одни электролиты в воде диссоциируются полностью, а другие частично и раствор устанавливает равновесие между ионами и недоссициируемыми молекулами. Показателем полной диссоциации является степень диссоциации 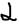 :
:  зависит от природы электролиты от концентрации и температуры (чем меньше концентрация и температура, тем
зависит от природы электролиты от концентрации и температуры (чем меньше концентрация и температура, тем 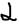 больше). По величине
больше). По величине 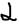 электролиты делятся на сильные и слабые. А)Сильные электролиты: 1 раствор диссоциируется на ионы полностью. К ним относятся почти все соли, сильные кислоты, сильные основания – гидрооксиды, щелочные металлы (NaOH, Ca(OH)2. Процесс диссоциации этих электролитов не обратим: HCl->H+Cl. Б)Слабые электролиты: В водном растворе диссоциируются лишь частично
электролиты делятся на сильные и слабые. А)Сильные электролиты: 1 раствор диссоциируется на ионы полностью. К ним относятся почти все соли, сильные кислоты, сильные основания – гидрооксиды, щелочные металлы (NaOH, Ca(OH)2. Процесс диссоциации этих электролитов не обратим: HCl->H+Cl. Б)Слабые электролиты: В водном растворе диссоциируются лишь частично 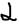 <1 (100%) и в растворе устанавливается равновесие между ионами и недиссоциируемыми молекулами. 1)органические кислоты, 2)слабые неогранические кислоты, 3)слабые и мало растворённые в воде основании (NH4OH), 4)мало растворённые в воде соли, 5)вода. Процесс диссоциации электролита обратим:
<1 (100%) и в растворе устанавливается равновесие между ионами и недиссоциируемыми молекулами. 1)органические кислоты, 2)слабые неогранические кислоты, 3)слабые и мало растворённые в воде основании (NH4OH), 4)мало растворённые в воде соли, 5)вода. Процесс диссоциации электролита обратим:  Между степенью диссоциации
Между степенью диссоциации 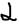 и коэффициентом “I” – существует соотношение:
и коэффициентом “I” – существует соотношение:  , где: n – число электролитов.
, где: n – число электролитов. 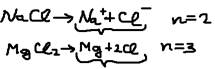
Константа диссоциации слабых электролитов (Кд): К равновесию которое устанавливает раствор слабого электролита между молекулами и ионами можно применить законы химического равновесия и записать выражение для константы, равновесия, которая называется константой диссоциации (Кд):  Кд – зависит от природы электролита и растворителя температуры, но не зависит от концентрации, чем больше (Кд) тем легче электролит диссоциируется между
Кд – зависит от природы электролита и растворителя температуры, но не зависит от концентрации, чем больше (Кд) тем легче электролит диссоциируется между  и кд существует соотношением:
и кд существует соотношением:  Многооснование кислоты и основание двух валентных металлов диссоциации ступенчато: H2CO3
Многооснование кислоты и основание двух валентных металлов диссоциации ступенчато: H2CO3 
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 800; Нарушение авторских прав?; Мы поможем в написании вашей работы!