
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние температуры на скорость гомогенных реакций. Химическое равновесие в гомогенных системах. Принцип Ле-Шателье
|
|
|
|
Ответ: Изучив более 4 тысяч реакций Вант-Гофф выявил правило: При неизменной концентрации скорость большей химической реакции увеличивается в 2-4 раза при повышении температуры на каждые 10 OС. 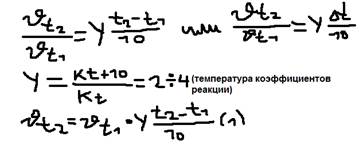 Пример 1: Некоторые реакции при 0 OC протекают со скоростью 1 моль/литр. Какой она будет при 100 OС?
Пример 1: Некоторые реакции при 0 OC протекают со скоростью 1 моль/литр. Какой она будет при 100 OС? 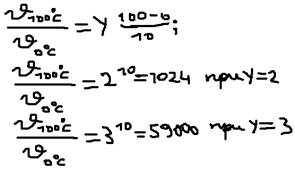 Удобно пользоваться не скоростью, а временем реакции, а т.к. время обратно пропорционально скорости, то выражение (1) можно записать:
Удобно пользоваться не скоростью, а временем реакции, а т.к. время обратно пропорционально скорости, то выражение (1) можно записать:  . Пример 2: При 120 OС некоторая реакция закончилась за 10 мин, за какое время оно закончится если её проводить при 150 OС (Y=2).
. Пример 2: При 120 OС некоторая реакция закончилась за 10 мин, за какое время оно закончится если её проводить при 150 OС (Y=2). 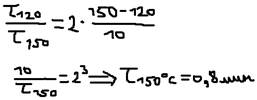 В чём причина такого резкого возрастания скорости при увеличении температуры. Причина заключается в том, что с повышением температуры возрастает число молекул обладающих энергией превышающую. Eакт, хотя общее число молекул остаётся неизменным. Зависимость константы от температуры определяется по формуле:
В чём причина такого резкого возрастания скорости при увеличении температуры. Причина заключается в том, что с повышением температуры возрастает число молекул обладающих энергией превышающую. Eакт, хотя общее число молекул остаётся неизменным. Зависимость константы от температуры определяется по формуле: 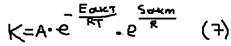 , где: A – предэкспоненционеный множитель (учитывающий число соударения молекул).
, где: A – предэкспоненционеный множитель (учитывающий число соударения молекул).
Химическое равновесие в гомогенных системах: Отмеченные выше все реакции делятся на: 1)необратимые – могут быть доведены или самопроизвольно доходят до конца (когда полностью расходуется одно из исходных веществ):  2)обратимые – это реакции одновременно протекающие в двух противоположных направлениях при данных условиях:
2)обратимые – это реакции одновременно протекающие в двух противоположных направлениях при данных условиях:  При неизменной концентрации: К1/K2=const.
При неизменной концентрации: К1/K2=const.  , где: кр – константа равновесия – она не зависит от концентрации, но зависит от tO и p. Выражение для кp записывают только концентрацию газообразных, парообразных и растворимых веществ, а концентрация жидких, твёрдых – не учитывают т.к. их концентрация в процессе реакции практически не меняется. Пример:
, где: кр – константа равновесия – она не зависит от концентрации, но зависит от tO и p. Выражение для кp записывают только концентрацию газообразных, парообразных и растворимых веществ, а концентрация жидких, твёрдых – не учитывают т.к. их концентрация в процессе реакции практически не меняется. Пример: 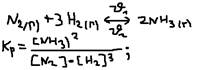 Если: Kp>1 – преобладает прямая реакция; Kp<1 – преобладает обратная реакция; Kp=1 – равновесие.
Если: Kp>1 – преобладает прямая реакция; Kp<1 – преобладает обратная реакция; Kp=1 – равновесие.
Принцип Ле-Шателье (1884 г.): Если на систему находящуюся в равновесии подействовать из вне (то есть изменить или концентрацию или температуру или давление), то равновесие смещается в сторону той реакции, которая препятствует этому воздействию (то есть в системе возникают процессы уменьшенного внешнего воздействия). 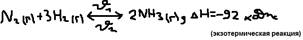 а)влияние изменений с (Т и P=const). При увеличении концентрации сходного начального продукта – равновесие смещается в сторону образования конечного продукта и наоборот. б)влияние изменения температуры T (C и P=const). При повышении T равновесие смещается в сторону эндотермической реакции, а при понижении – в сторону экзотермической. В)влияние изменения P (C и T=const). При увеличении P путём сжатия системы равновесие смещается в сторону реакции идущей с пониженным давлением т.е. в сторону меньшего числа молекул газообразных и парообразных веществ и наоборот. Концентрация жидких и твёрдых веществ не учитываются т.к. они – не сжимаются.
а)влияние изменений с (Т и P=const). При увеличении концентрации сходного начального продукта – равновесие смещается в сторону образования конечного продукта и наоборот. б)влияние изменения температуры T (C и P=const). При повышении T равновесие смещается в сторону эндотермической реакции, а при понижении – в сторону экзотермической. В)влияние изменения P (C и T=const). При увеличении P путём сжатия системы равновесие смещается в сторону реакции идущей с пониженным давлением т.е. в сторону меньшего числа молекул газообразных и парообразных веществ и наоборот. Концентрация жидких и твёрдых веществ не учитываются т.к. они – не сжимаются.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 913; Нарушение авторских прав?; Мы поможем в написании вашей работы!