
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорость гомогенных реакций. Закон действия масс. Константа скорости реакции
|
|
|
|
Ответ: Скорость химической реакции  - измеряется изменением концентрации реагирующих химических веществ в единицу времени
- измеряется изменением концентрации реагирующих химических веществ в единицу времени  . [c]=[моль/л], [
. [c]=[моль/л], [  ]=[мин,с],
]=[мин,с],  =[моль/л*мин или моль/л*с]. Рассмотрим некоторую реакцию: А+B=AB. Уменьшим концентрацию всех А и В и увеличим концентрацию АВ может протекать по линейному механизму
=[моль/л*мин или моль/л*с]. Рассмотрим некоторую реакцию: А+B=AB. Уменьшим концентрацию всех А и В и увеличим концентрацию АВ может протекать по линейному механизму  и по более сложному не линейному
и по более сложному не линейному  .
.  Скорость в пределах
Скорость в пределах  - скорость постоянна, её называют – средней скоростью. Vср – определяется
- скорость постоянна, её называют – средней скоростью. Vср – определяется  угла наклона прямой
угла наклона прямой  к оси времени.
к оси времени.  В этом случае скорость реакции в пределах
В этом случае скорость реакции в пределах  не постоянна, а изменяется, чем меньше
не постоянна, а изменяется, чем меньше  , тем ближе
, тем ближе  сред. приближается к истинной в момент времени
сред. приближается к истинной в момент времени  . Когда
. Когда  стремится к 0 получаем истинную (мгновенную) скорость:
стремится к 0 получаем истинную (мгновенную) скорость:  .
.  определяется
определяется  угла наклона к касательной кривой
угла наклона к касательной кривой 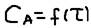 к оси времени. Факторы влияющие на скорость реакции: 1)природа реагирования вещества; 2)концентрация; 3)температура; 4)давление (для реакций с участием газов и паров); 5)присутствие катализатора и др. Мы знаем, что элемент активного взаимодействия происходит при столкновении молекул, однако не каждое столкновение приводит к реакции. Результат бывают столкновения только между активными молекулами. Активные молекулы – это молекулы обладающие повышенным запасом энергии, достаточным для осуществления данной реакции. Активные молекулы – появляются в результате перераспределении энергии которая происходит при их столкновении друг с другом не приводящие к реакции.
к оси времени. Факторы влияющие на скорость реакции: 1)природа реагирования вещества; 2)концентрация; 3)температура; 4)давление (для реакций с участием газов и паров); 5)присутствие катализатора и др. Мы знаем, что элемент активного взаимодействия происходит при столкновении молекул, однако не каждое столкновение приводит к реакции. Результат бывают столкновения только между активными молекулами. Активные молекулы – это молекулы обладающие повышенным запасом энергии, достаточным для осуществления данной реакции. Активные молекулы – появляются в результате перераспределении энергии которая происходит при их столкновении друг с другом не приводящие к реакции.  Число активных молекул определяется по формуле: Масквелла-Больцмана:
Число активных молекул определяется по формуле: Масквелла-Больцмана: 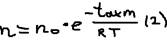 , где: n – число активным молекул, n0 – общее число молекул, e – основание натурального логарифма, R – универсальная газовая постоянная, Т – температура по Кельвину, Eакт (кДж/моль) – энергия активации. Энергии активации – это энергия необходимая для преодоления силы отталкивания электронных оболочек с ударяющейся молекулой, более строгая объяснение на примере конкретной реакции:
, где: n – число активным молекул, n0 – общее число молекул, e – основание натурального логарифма, R – универсальная газовая постоянная, Т – температура по Кельвину, Eакт (кДж/моль) – энергия активации. Энергии активации – это энергия необходимая для преодоления силы отталкивания электронных оболочек с ударяющейся молекулой, более строгая объяснение на примере конкретной реакции:  Преобразуя активные комплекса одновременно разрывает старые связи (затраты E) и образуются новые связи выделение E, в результате общей её активной равной их сумме меньшей. Энергия которая необходима для перевода реагирующих веществ в состояние активного комплекса и есть энергия активнее, чем Eа меньше чем выше реакций способной молекулы. Условно: Eакт<40 кДж/моль – быстрые реакции; Eакт.=40-120 – реакция средней скорости, Eакт>120 – медленные реакции. Другим важным фактором – является взаимная ориентация активной молекулы в момент соударения. Чтобы прошла реакция активной молекулы должны столкнуться активными участками. Вероятность надлежащей ориентации активных молекул в момент соударения определяется энтропией активации (Sакт):
Преобразуя активные комплекса одновременно разрывает старые связи (затраты E) и образуются новые связи выделение E, в результате общей её активной равной их сумме меньшей. Энергия которая необходима для перевода реагирующих веществ в состояние активного комплекса и есть энергия активнее, чем Eа меньше чем выше реакций способной молекулы. Условно: Eакт<40 кДж/моль – быстрые реакции; Eакт.=40-120 – реакция средней скорости, Eакт>120 – медленные реакции. Другим важным фактором – является взаимная ориентация активной молекулы в момент соударения. Чтобы прошла реакция активной молекулы должны столкнуться активными участками. Вероятность надлежащей ориентации активных молекул в момент соударения определяется энтропией активации (Sакт):  ,
, 
Закон действующих масс (ЗДМ), Константа скорости реакции: а)для гомогенных реакций: При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ возведённых в степени соответствия коэффициентов уравнений реакций: mA+nB->pC,  , где: к – коэффициент пропорциональности, который называют константой скорости реакции. Её физические свойства:
, где: к – коэффициент пропорциональности, который называют константой скорости реакции. Её физические свойства:  (при Сa=Cв=1моль/литр) т.е. это скорость реакции при концентрации реагентов 1 моль/литр её ещё называют удельной скоростью – это мера реакционной способности реагирующих веществ: 2SO2(г)+O2(г)=2SO3(г),
(при Сa=Cв=1моль/литр) т.е. это скорость реакции при концентрации реагентов 1 моль/литр её ещё называют удельной скоростью – это мера реакционной способности реагирующих веществ: 2SO2(г)+O2(г)=2SO3(г),  ; б)Для гетерогенных реакций: В этих реакциях с участием твёрдых веществ скорость определяется только концентрацией газов (паров) и растворённых веществ. А концентрация твёрдых веществ не учитываются. Кроме того играют также роль: 1)Площадь поверхности раздельных фаз; 2)Интенсивность масс обмено перемешивания. Например: C(г)+O2(г)=CO2(г).
; б)Для гетерогенных реакций: В этих реакциях с участием твёрдых веществ скорость определяется только концентрацией газов (паров) и растворённых веществ. А концентрация твёрдых веществ не учитываются. Кроме того играют также роль: 1)Площадь поверхности раздельных фаз; 2)Интенсивность масс обмено перемешивания. Например: C(г)+O2(г)=CO2(г). 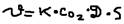 , где: Д – коэффициент диффузии (учитывает скорость подведения кислорода в зону реакции), S – площадь поверхности разд. фаз. Закон действующих масс: скорость гетерогенной реакции прямо пропорциональна концентрации газообразных и растворённых веществ возведённых в степени их коэффициентов в уравнения реакции, а также пропорциональна площади реакции поверхности и интенсивности масс обмена.
, где: Д – коэффициент диффузии (учитывает скорость подведения кислорода в зону реакции), S – площадь поверхности разд. фаз. Закон действующих масс: скорость гетерогенной реакции прямо пропорциональна концентрации газообразных и растворённых веществ возведённых в степени их коэффициентов в уравнения реакции, а также пропорциональна площади реакции поверхности и интенсивности масс обмена.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1371; Нарушение авторских прав?; Мы поможем в написании вашей работы!