
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энергия Гиббса. Направленность химических процессов
|
|
|
|
Ответ: Общая тенденция при химических взаимодействий характеризуется: 1)с одной стороны уменьшением энтропии из-за стремления частиц к объединению, то есть достижению максимального упор. Состояния (образования связей), 2)с другой стороны – увеличении энтропии из-за стремления частиц к беспорядочному движению, то есть достижению максимального разупорядоченного состояния. Суммарный эффект этих двух противоположных тенденций характеризуется изменением изобарно-изотермического потенциала (G) и выражается соотношением: 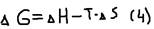 , где:
, где: 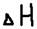 - энтропии фактор (характер стремления частиц к объединению),
- энтропии фактор (характер стремления частиц к объединению), 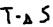 - энтропии фактор (характер стремления частиц к разъединению),
- энтропии фактор (характер стремления частиц к разъединению), 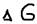 - энергия Гиббса (химическое сродство) – нереальность протекания данного процесса с данным условием – это критерий направленного процесса: Если:
- энергия Гиббса (химическое сродство) – нереальность протекания данного процесса с данным условием – это критерий направленного процесса: Если: 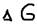 <0 – возможен самопроизвольный процесс,
<0 – возможен самопроизвольный процесс, 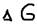 >0 – невозможен самопроизвольный процесс,
>0 – невозможен самопроизвольный процесс, 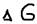 =0 – равновесие (реакция обратима). Крайние случаи: 1)t->1К (-273OС)
=0 – равновесие (реакция обратима). Крайние случаи: 1)t->1К (-273OС) 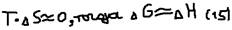 Это говорит о том, что при такой температуре преобладает энтропийний фактор, то есть частицы стремятся к объединению. При этой температуре – прекращаются все виды движений атомов и молекул, то есть наступает полный порядок расположения частиц. Сущность 3 начала термодинамики: Абсолютная величина энтропии идеального кристалла при абсолютном нуле равна нулю. 2)при t->5000 OC,
Это говорит о том, что при такой температуре преобладает энтропийний фактор, то есть частицы стремятся к объединению. При этой температуре – прекращаются все виды движений атомов и молекул, то есть наступает полный порядок расположения частиц. Сущность 3 начала термодинамики: Абсолютная величина энтропии идеального кристалла при абсолютном нуле равна нулю. 2)при t->5000 OC, 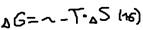 энтропийний фактор можно пренебречь. При таким температурах преобладает энтропийный фактор то есть стремление частиц к разъединению превышает их стремление к объединению, то есть образованию связи. При этих температурах разрываются все химические связи и молекулы становятся термически дессоциированными. При средних температурах величина
энтропийний фактор можно пренебречь. При таким температурах преобладает энтропийный фактор то есть стремление частиц к разъединению превышает их стремление к объединению, то есть образованию связи. При этих температурах разрываются все химические связи и молекулы становятся термически дессоциированными. При средних температурах величина 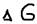 и знак зависят от абсолютной величины энтропийного фактора,
и знак зависят от абсолютной величины энтропийного фактора,  , где: ni, mi – коэффициенты,
, где: ni, mi – коэффициенты, 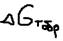 - в справочниках. Пример: Будет ли данная реакция протекать произвольно. CH4(г)+2H2O(п)=CO2(г)+4H2(г),
- в справочниках. Пример: Будет ли данная реакция протекать произвольно. CH4(г)+2H2O(п)=CO2(г)+4H2(г), 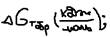 CH4=-50,9; H2O=-228,6; CO2=-394,4; H2=0.
CH4=-50,9; H2O=-228,6; CO2=-394,4; H2=0. 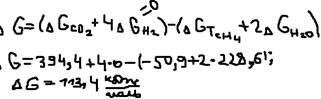 не будет протекать произвольно т.к.
не будет протекать произвольно т.к.  . Мы только, что установили, что величина и знак
. Мы только, что установили, что величина и знак  определяет возможность или невозможность данного процесса в данном условии. Но опыт показывает, что одни реакции идут с очень большой скоростью (взрыв), а другие очень медленно – процессы в земной коре. Химическая кинетика – изучает закономерности протекания химических реакций во времени, то есть их скорости и механизмы.
определяет возможность или невозможность данного процесса в данном условии. Но опыт показывает, что одни реакции идут с очень большой скоростью (взрыв), а другие очень медленно – процессы в земной коре. Химическая кинетика – изучает закономерности протекания химических реакций во времени, то есть их скорости и механизмы.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 779; Нарушение авторских прав?; Мы поможем в написании вашей работы!