
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Донорно-акцепторная связь. Водородная связь
|
|
|
|
Ответ: ДА-связь (Донорно-акцепторная связь). 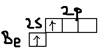 ДА-связь возникает между атомами А и В в том случае если атом В имеет – свободную не поделенную пару электронов, которую он отдаёт в общее пользование атому А, имеющего свободную орбиталь.
ДА-связь возникает между атомами А и В в том случае если атом В имеет – свободную не поделенную пару электронов, которую он отдаёт в общее пользование атому А, имеющего свободную орбиталь.  Пример:
Пример: 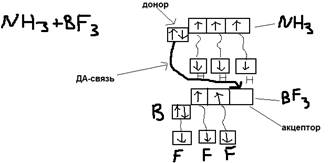 Соединения в которых действует одна или несколько ДА-связей – называются комплексными.
Соединения в которых действует одна или несколько ДА-связей – называются комплексными. 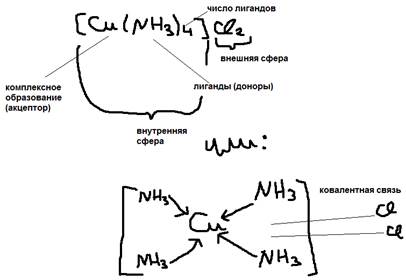 Комплексное образование (акцепторные элементы) могут быть: а)ионы d-металлов Ag+ Сu+2 Pt+4; б)нейтральные d-металлы Fe; Mn; Mo; в)атомы неметаллов с положительностью степенью окисления: B+3, P+5. Лигандами (донорами) – могут быть: а)отрицательно заряженные ионы: OH-, Cl-, Br-, CN-, S2-, SO42-, NO2- и другие кислотные остатки. б)нейтральные полярные молекулы: H2O, NH3, PH3, CO, NO. Число показывающее сколько лигандов присоединяется к комплексному образованию – называет координационным числом последнего КЧ=1-12 (чаще 4 и 6). Пример: Записана формула комплексного соединения состава: PtCl4*2NH3*3H2O (КЧ=6) [Pt(NH3)2(H2O)3Cl]Cl3 Молекула комплексного соединения (иона) в целом электро нейтральна, то есть заряд внешней сферы равен заряду внутренней сферы с обратным знаком. Заряд внутри сферы (w) равен сумме заряда комплекса образовательного и легенды: w=Zk+ZN
Комплексное образование (акцепторные элементы) могут быть: а)ионы d-металлов Ag+ Сu+2 Pt+4; б)нейтральные d-металлы Fe; Mn; Mo; в)атомы неметаллов с положительностью степенью окисления: B+3, P+5. Лигандами (донорами) – могут быть: а)отрицательно заряженные ионы: OH-, Cl-, Br-, CN-, S2-, SO42-, NO2- и другие кислотные остатки. б)нейтральные полярные молекулы: H2O, NH3, PH3, CO, NO. Число показывающее сколько лигандов присоединяется к комплексному образованию – называет координационным числом последнего КЧ=1-12 (чаще 4 и 6). Пример: Записана формула комплексного соединения состава: PtCl4*2NH3*3H2O (КЧ=6) [Pt(NH3)2(H2O)3Cl]Cl3 Молекула комплексного соединения (иона) в целом электро нейтральна, то есть заряд внешней сферы равен заряду внутренней сферы с обратным знаком. Заряд внутри сферы (w) равен сумме заряда комплекса образовательного и легенды: w=Zk+ZN 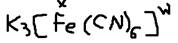 Пример №1:
Пример №1:  Пример2:
Пример2:  Комплексное соединение будучи сильными электролитами легко диссоциируется в водных растворах но внутреннюю сферу комплексного ион и внешнюю сферу:
Комплексное соединение будучи сильными электролитами легко диссоциируется в водных растворах но внутреннюю сферу комплексного ион и внешнюю сферу: 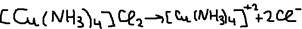 Внутренняя же сфера (комплексный ион) очень значительно диссоциируется на комплекс образовательный и легенды то есть является слабым электролитом.
Внутренняя же сфера (комплексный ион) очень значительно диссоциируется на комплекс образовательный и легенды то есть является слабым электролитом. 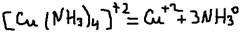 Устойчивость комплексного иона характеризует К (нестойкости):
Устойчивость комплексного иона характеризует К (нестойкости): 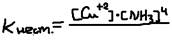 или больше Кнест. Тем меньше прочности комплексного иона.
или больше Кнест. Тем меньше прочности комплексного иона.
Дативная вязь – это такая связь, когда одна частица является одновременно и донором и акцептором электрона.  Водородная связь: Давно было замечено что соединения в которых атом водорода непосредственно связан с: N, O, F (Сl) – обладает рядом аномальным свойств. Это проявляется в температуре плавления, температуре кипения подобных соединений. Например соединение водорода с элементами 6 группы. Известно, что среди однотипных соединений одной подгруппы температура плавления, температура кипения – зависят от молярной массы соединения, чем она больше тем больше температура плавления и температура кипения.
Водородная связь: Давно было замечено что соединения в которых атом водорода непосредственно связан с: N, O, F (Сl) – обладает рядом аномальным свойств. Это проявляется в температуре плавления, температуре кипения подобных соединений. Например соединение водорода с элементами 6 группы. Известно, что среди однотипных соединений одной подгруппы температура плавления, температура кипения – зависят от молярной массы соединения, чем она больше тем больше температура плавления и температура кипения.  Эти и другие особенности подобных соединений объясняются способностью атома водорода (H) соединённого с атомом сильно электроотрицательного элемента, к образованию ещё одной химической связи с другим подобным атомом другой молекулы – такая связь называется – водородной связью (HF).
Эти и другие особенности подобных соединений объясняются способностью атома водорода (H) соединённого с атомом сильно электроотрицательного элемента, к образованию ещё одной химической связи с другим подобным атомом другой молекулы – такая связь называется – водородной связью (HF).  При взаимодействии H+F атом F оттягивает на себя электронное облаком с атомом водорода (H), приобретая при этом дополнительный отрицательный заряд. А ядро атома водорода с внешней стороны лишается электронного облака (оголяется). Теперь этот протон электрически взаимодействует с электронной оболочкой соседней молекулы HF, и внедряется в её, образуя водородную связь. Такая связь характеризуется только для атомов H, т.к. все другие атомы имеют внутренние электрические слои, играющие экранирующую роль. Водородная связь менее прочна, чем ковалентная связь. Eкс=125-420 кДж/моль; Eвс=15-40 кДж/моль. Однако этой энергии недостаточно, чтобы вызвать ассоциацию молекулы, то есть их объединение, в димеры, тримеры, тетромеры… Именно ассоциация молекулы затрудняющая их отрыв друг от друга и служит причиной аномально высокой Tплавления и Tкипения таких соединений как: HF, H2O, NH3. Водородная связь как менее прочна чем ковалентная связь обозначается точками:
При взаимодействии H+F атом F оттягивает на себя электронное облаком с атомом водорода (H), приобретая при этом дополнительный отрицательный заряд. А ядро атома водорода с внешней стороны лишается электронного облака (оголяется). Теперь этот протон электрически взаимодействует с электронной оболочкой соседней молекулы HF, и внедряется в её, образуя водородную связь. Такая связь характеризуется только для атомов H, т.к. все другие атомы имеют внутренние электрические слои, играющие экранирующую роль. Водородная связь менее прочна, чем ковалентная связь. Eкс=125-420 кДж/моль; Eвс=15-40 кДж/моль. Однако этой энергии недостаточно, чтобы вызвать ассоциацию молекулы, то есть их объединение, в димеры, тримеры, тетромеры… Именно ассоциация молекулы затрудняющая их отрыв друг от друга и служит причиной аномально высокой Tплавления и Tкипения таких соединений как: HF, H2O, NH3. Водородная связь как менее прочна чем ковалентная связь обозначается точками: 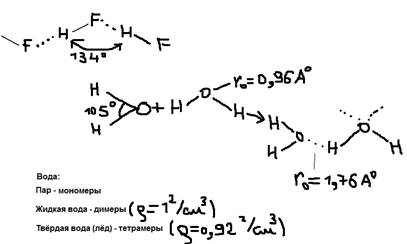
13)Металлическая связь. Структура твёрдых тел.
Ответ: Металлическая связь: Большие элементы таблицы Менделеева (4,5) – это металлы, металлы имеют ряд общих свойств: 1)металлический блеск; 2)высокая тепло/электро проводность; 3)пластичность; 4)восстановительная способность (легко отдаёт электроны). На внешнем уровне их атомов мало электронов  но зато в избытке свободные орбитали, поэтому электроны одного металла могут переходить к другому атому и наоборот.
но зато в избытке свободные орбитали, поэтому электроны одного металла могут переходить к другому атому и наоборот.  Эти де локализованные мигрирующие электроны находятся на гигантских орбиталях, которые простираются по всей кристаллической решётке, эти орбитали по энергии группируются в отдельные зоны – валентную зону и зону проводимости. Валентная зона –располагается ниже по энергии, электроны частично заполняющие зоны проводимости, могут очень легко перемещаться по всему кристаллу.
Эти де локализованные мигрирующие электроны находятся на гигантских орбиталях, которые простираются по всей кристаллической решётке, эти орбитали по энергии группируются в отдельные зоны – валентную зону и зону проводимости. Валентная зона –располагается ниже по энергии, электроны частично заполняющие зоны проводимости, могут очень легко перемещаться по всему кристаллу. 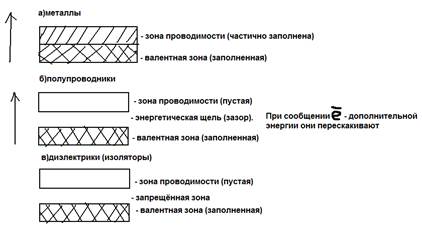 Металлическую с труктуру можно представить в виде кристаллической решётки в узлах которой находятся нейтральный атом и положительно заряженные ионы, а между ними “свободные перемещённые ионы” (“море электронов). Металлическая связь в отличии от ковалентной связи не обладает направлением и насыщаемостью.
Металлическую с труктуру можно представить в виде кристаллической решётки в узлах которой находятся нейтральный атом и положительно заряженные ионы, а между ними “свободные перемещённые ионы” (“море электронов). Металлическая связь в отличии от ковалентной связи не обладает направлением и насыщаемостью.
Структура твёрдых тел: Различают состояния твёрдых веществ: а)аморфное, б)кристаллическое. Большинство твёрдых тел – кристаллические. Кристаллические тела – плавятся при строго определённой температуре, тем отличаются от аморфных веществ. Кристаллические тела имеют геометрическую форму и характеризуются анизатропией (их свойство-теплопроводность, электрический раствор и т.д.) различны по разным направлениям кристаллов. У аморфных тел эти свойства одинаковы по всем направлениям, то есть они изотропны (стеклообразны). Наиболее распространённое аморфное вещество – это стекло поэтому их ещё называют стеклообразными. В зависимости от вида частиц образованных кристаллов и характеристики связи между ними различают четыре вида решёток: 1)молекулярная:  В её узлах находятся полярные и неполярные молекулы связанные слабыми силами межмолекулярного взаимодействия, поэтому у них малая твёрдость, низкая Тплавления, хорошая растворимость. 2)атомная:
В её узлах находятся полярные и неполярные молекулы связанные слабыми силами межмолекулярного взаимодействия, поэтому у них малая твёрдость, низкая Тплавления, хорошая растворимость. 2)атомная: 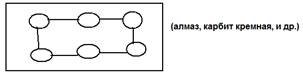 В её узлах находятся атомы связанные прочными ковалентными связями, поэтому высокая твёрдость, высокая Тплавления, плохая растворимость в H2O; 3)ионная:
В её узлах находятся атомы связанные прочными ковалентными связями, поэтому высокая твёрдость, высокая Тплавления, плохая растворимость в H2O; 3)ионная:  В её узлах находятся положительные и отрицательные ионы связанные силами Кулоновского притяжения (низкая твёрдость, хорошая растворимость); 4)металлическая решётка.
В её узлах находятся положительные и отрицательные ионы связанные силами Кулоновского притяжения (низкая твёрдость, хорошая растворимость); 4)металлическая решётка.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 3090; Нарушение авторских прав?; Мы поможем в написании вашей работы!