
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ковалентная связь. Свойства ковалентной связи. Понятие о теории гибридизации
|
|
|
|
Ответ: Ковалентная связь (КС) – образуется в результате “спаривания” электронов, которое возможно когда спины электронов соединения атомов противоположны. За счёт взаимодействия магнитных полей этих электронов атомы стягиваются в молекулу, образуя пару обобществлённых электронов (связующее электронное облако).  При этом каждый из атомов молекулу приобретает устойчивую структуру инертного элемента.
При этом каждый из атомов молекулу приобретает устойчивую структуру инертного элемента.  Образование ковалентной связи может происходить за счёт образования одной, двух, или трёх электронных пар. Пример №1:
Образование ковалентной связи может происходить за счёт образования одной, двух, или трёх электронных пар. Пример №1: 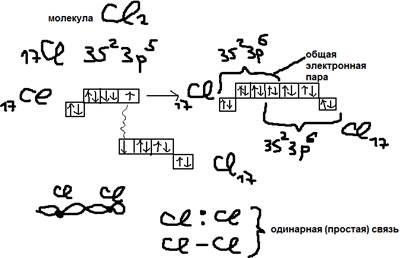 Пример №2:
Пример №2:  Пример №3:
Пример №3:  Ковалентная связь тем более прочна: 1)чем больше перекрывание электронного облака; 2)чем выше плотность связующего электронного облака.
Ковалентная связь тем более прочна: 1)чем больше перекрывание электронного облака; 2)чем выше плотность связующего электронного облака.
Свойства ковалентной связи: 1)Длина связи (r0) – это среднее расстояние между ядрами взаимодействующих атомов.  2)энергия связи (Eсв) (кДж/моль) – это энергия необходимая для разрыва связи. 3)Кратность связи – это общее число электронных пар, ответственных за образование связи.
2)энергия связи (Eсв) (кДж/моль) – это энергия необходимая для разрыва связи. 3)Кратность связи – это общее число электронных пар, ответственных за образование связи. 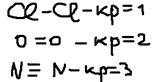 4)Насыщаемость – атом не может принять другой атом больше, чем он имеет холостых электронов.
4)Насыщаемость – атом не может принять другой атом больше, чем он имеет холостых электронов. 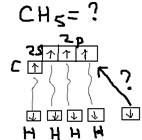 5)Ковалентность – она определяется числом всех орбиталей участвующих в образовании связей (как занятых холостых электронов, так и свободных).
5)Ковалентность – она определяется числом всех орбиталей участвующих в образовании связей (как занятых холостых электронов, так и свободных). 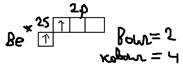 6)Направленность – ковалентность возникает направленно в которой достигается максимальное перекрывание орбиталей взаимодействием атомов.
6)Направленность – ковалентность возникает направленно в которой достигается максимальное перекрывание орбиталей взаимодействием атомов. 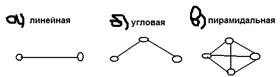
Гибридизация: Образование связи может происходить за счёт электронных облаков одного атома, но разной их конфигурации (s и p) орбитали, чаще всего это происходит у атомов в возбуждённом состоянии. При этом образование связей происходит гибридизацией электронных облаков, то есть комбинирование s и p орбиталей так, что энергия их выравнивается, форма изменяется и образуются равноценные гибридные орбитали – это приводит к одиночному прочному образованию связей. А)SP-гибридизация (характеристика для двух валентных атомов): Пример: 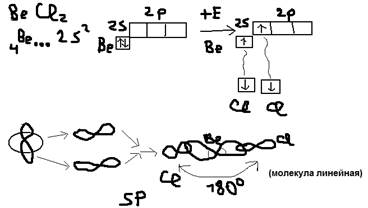 б)SP2-гибридизация (характеристика для 3-ёх валентных атомов) Пример:
б)SP2-гибридизация (характеристика для 3-ёх валентных атомов) Пример: 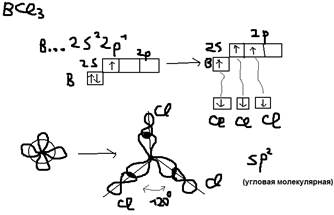 в)sp3-гибридизация (для 4-ёх валентных атомов). Пример:
в)sp3-гибридизация (для 4-ёх валентных атомов). Пример: 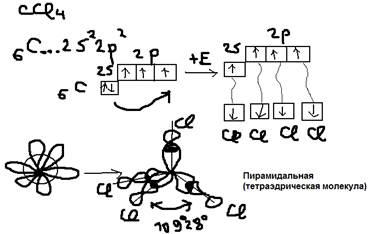
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1139; Нарушение авторских прав?; Мы поможем в написании вашей работы!