
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ионная связь. Типы ковалентных молекул
|
|
|
|
Ответ: Ионная связь: Предельным случаем поляризации ковалентной связи – является ионная связь, которая сопровождается практически полным сцеплением связующего электронного облака к большее электроотрицательному атому, с последующим электростатическим притяжением образовавшихся разноименно заряженных ионов. При образовании ионной связи каждый ион приобретает устойчивую конфигурацию: s2p6. 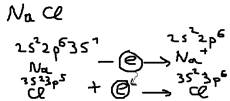 Чёткой границы между ионной и ковалентной связью – не существует, условно принимают разность: 1)ЭО
Чёткой границы между ионной и ковалентной связью – не существует, условно принимают разность: 1)ЭО 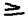 2,1 – ионная связь; 2)0<разность ЭО<2,1 – ковалентная полярная связь; 3)разность ЭО=0 – ковалентной неполярная связь. LiF: (4,0-1,0=3,0) – ионная связь. HF: (4,0-2,1=1,3) – ковалентная полярная связь. Cl2: (3,0-3,0=0) – ковалентная неполярная связь. K S C N. K-S: 2,5-0,8=1,7 – обладает большой полярностью. S-C: 2,5-2,5=0. С-N: 3,0-2,5=0,5.
2,1 – ионная связь; 2)0<разность ЭО<2,1 – ковалентная полярная связь; 3)разность ЭО=0 – ковалентной неполярная связь. LiF: (4,0-1,0=3,0) – ионная связь. HF: (4,0-2,1=1,3) – ковалентная полярная связь. Cl2: (3,0-3,0=0) – ковалентная неполярная связь. K S C N. K-S: 2,5-0,8=1,7 – обладает большой полярностью. S-C: 2,5-2,5=0. С-N: 3,0-2,5=0,5.
По направлению различают следующие виды связей: 1)  - связь (сигма) – это имеющая ось симметрии, она располагается вдоль межъядерной оси:
- связь (сигма) – это имеющая ось симметрии, она располагается вдоль межъядерной оси: 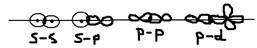 2)
2) 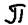 - связь (пи) – это имеющая плоскость симметрии, оно образуется между p и d орбиталями по обе стороны от межъядерной оси:
- связь (пи) – это имеющая плоскость симметрии, оно образуется между p и d орбиталями по обе стороны от межъядерной оси: 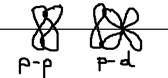 3)
3) 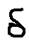 - связь (дельта) – образуется при одновременном перекрывании всех 4-ёх лепестков d орбиталей:
- связь (дельта) – образуется при одновременном перекрывании всех 4-ёх лепестков d орбиталей:  По прочности:
По прочности: 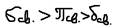 - примерно в 1,5 раза больше чем
- примерно в 1,5 раза больше чем  -связь поэтому в химических реакциях с участием атомов с кратной связью первой разрывается
-связь поэтому в химических реакциях с участием атомов с кратной связью первой разрывается 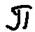 - связь.
- связь. 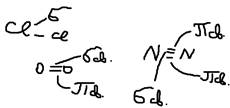 4)Поляризуемость связи. Ковалентная поляризация: При взаимодействии двух атомов имеющих одинаковое значение ЭО – связующее электронное облако находится по середине межъядерной оси, то есть не смещено ни к какому атому (разность ЭО=1). Такая связь называется ковалентной неполярной связью, а молекулы – неполярными (+-) например: H2, Cl2, O2. L=0, M=0. При соединении атомов имеющих различные значения ЭО – связующее электронное облако поляризуется то есть смещается в сторону того атома ЭО которого выше, образуя при этом связь которая называется ковалентная полярная связь (HCl). ЭОh=2.1 Эол=3,0 разность ЭО:3.0-2.1=0.9>0 В молекуле HCl связующее электронное облако смещается в сторону атому хлора, в результате чего на атоме хлора возникает некоторый отрицательный заряд (-
4)Поляризуемость связи. Ковалентная поляризация: При взаимодействии двух атомов имеющих одинаковое значение ЭО – связующее электронное облако находится по середине межъядерной оси, то есть не смещено ни к какому атому (разность ЭО=1). Такая связь называется ковалентной неполярной связью, а молекулы – неполярными (+-) например: H2, Cl2, O2. L=0, M=0. При соединении атомов имеющих различные значения ЭО – связующее электронное облако поляризуется то есть смещается в сторону того атома ЭО которого выше, образуя при этом связь которая называется ковалентная полярная связь (HCl). ЭОh=2.1 Эол=3,0 разность ЭО:3.0-2.1=0.9>0 В молекуле HCl связующее электронное облако смещается в сторону атому хлора, в результате чего на атоме хлора возникает некоторый отрицательный заряд (- 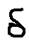 ), а на атоме водорода (+
), а на атоме водорода (+ 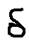 ). Эти заряды называют эффективными. Полярная связь характеризуется – дипольным моментом:
). Эти заряды называют эффективными. Полярная связь характеризуется – дипольным моментом: 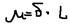 Дебай (Д). 1Д=0,33*10-28 кл*м. Молекула с ковалентной полярной связью называется – полярной молекулой или диполем.
Дебай (Д). 1Д=0,33*10-28 кл*м. Молекула с ковалентной полярной связью называется – полярной молекулой или диполем. 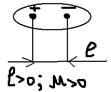
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 792; Нарушение авторских прав?; Мы поможем в написании вашей работы!