
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Развитие периодического закона. Энергия ионизации, сродство к электрону, электроотрицательность
|
|
|
|
Ответ: Д.И. Мендеев: свойства простых тел, а также формы и свойства соединений элементов – находятся в периодической зависимости – от величины атомных весов элементов. (1869г.). Современная формулировка периодического закона: свойства элементов находятся в периодической зависимости – от зарядов ядерных атомов (а порядковый номер элемента – равен заряду ядра). Теория строения атома – раскрыла физический смысл периодического закона: периодическое изменение свойств химических элементов – происходит в следствие периодического возвращения к аналогичным электронным группировкам.
Энергия ионизации (I): Очень важным свойством элементов – является способность их атомов отдавать электроны, количественной мерой металличности, и является – энергия ионизации (I). Энергия ионизации (I) – это количество энергии, которую необходимо затратить для отрыва электрона – от: нейтрального атома, или иона. Различают: I1 – энергия для отрыва первого электрона – от нейтрального атома: I2 – энергия для отрыва второго электрона – от образовавшегося однозарядного положительного иона, и т.д. Всегда: I1<I2<I3. I – определяет восстановительную способность атома – т.е. его способность отдавать электроны. Чем меньше I, тем легче атом отдаёт электроны т.е. тем более сильным восстановителем – он является. В главных подгруппах сверху-вниз восстановителя свойства усиливаются (т.к. I – уменьшается), а в периодах слева-направо – уменьшаются (т.к. I – увеличивается).
Сродство к электрону (E). E – это количество энергии, которое выделяется при присоединении электрона – к: нейтральному атому, или иону. E – определяет окислительную способность атома т.е. его способность – принимать электроны. Чем больше E, тем легче атом – присоединяет электроны т.е. более сильным окислителем – он (E) является. E1>E2>E3. В главных подгруппах сверху-вниз – окислительные свойства – уменьшаются, а в периодах слева-направо – усиливаются. Значит наиболее сильный восстановитель – это Франций (Fr), а самый сильный окислитель – фтор (F).
Электроотрицательность (ЭО). ЭО – это способность атома, оттягивать на себя электроны – от других атомов, при образовании химической связи. ЭО=1/2*(I+E) – это уравнение Малликена. Обычно пользуются – относительными значениями ЭО, т.е. отношением ЭО данного элемента – к ЭО лития (Li), величину которого – условно принимают за единицу: 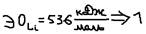 ЭО (Таблица Полинга):
ЭО (Таблица Полинга):  Условно считают, если ЭО<<2,0 – это металлы; ЭО>>2,0 – это неметаллы; ЭО примерно 2,0 – это “полуметаллы”.
Условно считают, если ЭО<<2,0 – это металлы; ЭО>>2,0 – это неметаллы; ЭО примерно 2,0 – это “полуметаллы”.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 653; Нарушение авторских прав?; Мы поможем в написании вашей работы!