
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Квантовые числа. Главное, орбитальное, магнитное, спиновое числа
|
|
|
|
Ответ: Волновое уравнение Шредингера (1926г.) – это дифференциальное уравнение в частных производных – для одного электрона атома водорода, в трёхмерном пространстве: 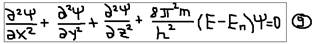 , где: x, y, z – координаты; E – полная энергия электрона; Eп – потенциальная энергия электрона;
, где: x, y, z – координаты; E – полная энергия электрона; Eп – потенциальная энергия электрона; 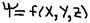 - волновая функция (характеризует амплитуду трёхмерной волны) физического смысла – не имеет, а физический смысл – имеет величина
- волновая функция (характеризует амплитуду трёхмерной волны) физического смысла – не имеет, а физический смысл – имеет величина  - она характеризует плотность вероятности нахождения электрона – в том, или ином месте атома.
- она характеризует плотность вероятности нахождения электрона – в том, или ином месте атома. 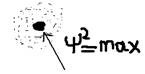 Выводы: 1)Электрон в атоме – волновой объект – поэтому атом вследствие волнового характера электрона – не имеет: точных геометрических размеров, и неизменной формы. Хотя электрон – и волновой объект, но потеря атомов электрона (ионизация атома) – происходит в виде: единого, и неделимого электрона – как частицы. Строение электронных оболочек атома. Следствием решения уравнения Шредингера – являются 3 квантовых числа, которые характеризуют поведение электронов – в атоме.
Выводы: 1)Электрон в атоме – волновой объект – поэтому атом вследствие волнового характера электрона – не имеет: точных геометрических размеров, и неизменной формы. Хотя электрон – и волновой объект, но потеря атомов электрона (ионизация атома) – происходит в виде: единого, и неделимого электрона – как частицы. Строение электронных оболочек атома. Следствием решения уравнения Шредингера – являются 3 квантовых числа, которые характеризуют поведение электронов – в атоме.
Главное квантовое число “n” – характеризует общую энергию электрона, или его энергетический уровень, и определяет размеры атомной орбитали (чем больше “n” – тем больше размер орбитали, тем дальше электрон находится от ядра, тем большей энергией он обладает). “n” – принимает значение: 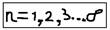 При n=1 возможно 1 (одно) решение уравнения Шредингера; n=2 возможно 4 решения уравнения; n=3 возможно 9 решений уравнений; т.е. при n – возможно n2 решений. Эти решения – представляют собой: орбитальные волновые функции, или орбитали электрона. Орбиталь (“электронное облако”) – можно представить как некоторую область вокруг ядра, куда электрон имеет доступ – но не всегда её (область) – заполняет. Совокупность орбиталей – с одинаковым n называется – уровнем. n – совпадает с номером периода данного элемента в таблице Менделеева. Таким образом, число орбиталей, на уровне:
При n=1 возможно 1 (одно) решение уравнения Шредингера; n=2 возможно 4 решения уравнения; n=3 возможно 9 решений уравнений; т.е. при n – возможно n2 решений. Эти решения – представляют собой: орбитальные волновые функции, или орбитали электрона. Орбиталь (“электронное облако”) – можно представить как некоторую область вокруг ядра, куда электрон имеет доступ – но не всегда её (область) – заполняет. Совокупность орбиталей – с одинаковым n называется – уровнем. n – совпадает с номером периода данного элемента в таблице Менделеева. Таким образом, число орбиталей, на уровне: 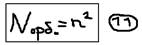
Орбитальное квантовое число “l (эль)” – характеризует форму электронного облака (но только – для атома водорода). Для всех других атомов l (эль) – характеризует также и энергию. В этих атомах электроны данного уровня – группируются в подуровни – разные по энергии. Каждому значение l (эль) – соответствует свой энергетический подуровень. l(эль) – принимает значение:  Например: n=1; l(эль)=0 (s-). Nорб.=12=1 (одна s- орбиталь).
Например: n=1; l(эль)=0 (s-). Nорб.=12=1 (одна s- орбиталь). 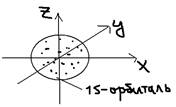 2)n=2; l(эль)=0,1 (s-, и p-). Nорби.=22=4 (одна s-орбиталь + 3p – орбитали).
2)n=2; l(эль)=0,1 (s-, и p-). Nорби.=22=4 (одна s-орбиталь + 3p – орбитали).  - p-орбиталь.
- p-орбиталь.  3)n=3; l(эль)=0,1,2 (s-, p-, d-) Nорб.=32=9 (одна s+3p+5d орбиталей)
3)n=3; l(эль)=0,1,2 (s-, p-, d-) Nорб.=32=9 (одна s+3p+5d орбиталей) 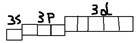 4)n=4; l(эль)=0,1,2,3 (s-, p-, d-, f-). Nорб.=42=16 (1s+3p+5d+7f орбиталей).
4)n=4; l(эль)=0,1,2,3 (s-, p-, d-, f-). Nорб.=42=16 (1s+3p+5d+7f орбиталей). 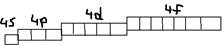 По энергии: Es<Ep<Ed<Ef.
По энергии: Es<Ep<Ed<Ef.
Магнитное квантовой число  – характеризует ориентацию электронного облака в пространстве – относительно магнитного поля, и определяет вытянутость электронного облака – вдоль оси. Приинимает значение:
– характеризует ориентацию электронного облака в пространстве – относительно магнитного поля, и определяет вытянутость электронного облака – вдоль оси. Приинимает значение:  =-
=- 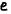 (минус эль) 0 (ноль)
(минус эль) 0 (ноль)  (плюс эль). Число значение
(плюс эль). Число значение  для подуровня – равно числу орбиталей для этого подуровня. а)
для подуровня – равно числу орбиталей для этого подуровня. а)  =0 (s-);
=0 (s-);  =0
=0 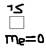 б)
б)  =1 (p-);
=1 (p-);  =-1,0,1
=-1,0,1  в)
в)  =2 (d-);
=2 (d-);  =-2,-1,0,1,2
=-2,-1,0,1,2 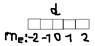
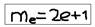
Спиновое квантовое число (ms) – характеризует внутреннее движение электрона – спин, и определяет направление вращения электрона – вокруг собственной оси. Принимает – только два значения: ms=1/2, и -1/2.  Заполнение орбитали электронами – определяется 3-мя основными положениями: а)принципом Паули; б)принципом наименьшей энергии; в)правилом Гунда.
Заполнение орбитали электронами – определяется 3-мя основными положениями: а)принципом Паули; б)принципом наименьшей энергии; в)правилом Гунда.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 4161; Нарушение авторских прав?; Мы поможем в написании вашей работы!