
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Диссоциация воды. Ионное произведение воды. Водородный показатель, рН
|
|
|
|
До сих пор мы предполагали и рассматривали процесс диссоциации растворенного вещества под действием молекул растворителя. Но возможен процесс и самодиссоциации растворителя. То есть взаимодействие между собственными молекулами растворителя настолько значительно, что может привести к разрыву связей внутри молекул с образованием новых заряженных частиц – ионов. Например, вода диссоциирует на ионы водорода и гидроксила
Н2Ожид. ↔ Н+раствор + ОН-раствор, и как следствие – чистая вода обладает электропроводностью (правда, незначительной). Следует отметить, что в воде протон сольватирован и существует в виде иона гидроксония (гидрония) Н3О+. С учетом этого уравнение процесса диссоциации воды (автопротолиз воды) можно записать:
2Н2О ↔ Н3О+ + ОН- . На практике, однако, чаще используют форму записи Н+, чем Н3О+. В условиях равновесия процесс самодиссоциации воды можно охарактеризовать константой диссоциации Кн2о: Кд(н2о)=[ H+]⋅[OH−]/[ H2O]
Ее величина очень мала и при 22 оС составляет значение равное 1,8 ⋅10-16. Из этого следует, что в воде образуется очень незначительное количество ионов водорода Н+ и гидроксила ОН- (числитель выражения), а следовательно, и распадается незначительная часть молекул воды. Поэтому можно без большой ошибки считать равновесную концентрацию нераспавшихся молекул воды
[H2O] в приведенном выражении равной концентрации исходной воды (до диссоциации), которая для одного литра воды, принимая во внимание плотность воды и ее молярную массу, равна [H2O] = 55,56 моль/л, где 1000 г – масса одного литра воды, 18 – молярная масса воды. Если подставить величину концентрации воды в выражение константы диссоциации, то получим: 1,8⋅10-16 = [H+][OH−]/55,56 или [H+][OH-]=Кводы=1,8.10-16/55,56 = 1⋅10-14.
Последнее выражение ─ произведение концентраций ионов водорода и гидроксила ─ называют ионным произведением воды. Величина эта постоянная при данной температуре и характеризует соотношение концентраций ионов водо-
рода и гидроксила чистой воды. Из ионного произведения воды видно, что концентрации ионов водорода и гидроксила равны между собой и в чистой воде составляют величину, равную: [H+] = [OH-] = 1⋅10-7 моль/л.
Это и понятно, так как каждая распавшаяся молекула воды поставляет одновременно один ион водорода Н+ и один ион гидроксила ОН-. Если вспомнить, что ион водорода Н+ является носителем кислотных свойств, а ион гидроксила ОН- ─ основных, то при равенстве их концентраций
[H+] = [OH-] = 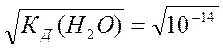 =10-7 моль/л вода является нейтральным электролитом: ни кислым, ни основным. Вода выступает в роли амфолита. Если же концентрация ионов водорода [H+] в водном растворе будет в силу каких-то причин больше концентрации ионов гидроксила [OH-] (например, при добавлении молекул кислоты, распадающихся на ионы водорода и кислотного остатка), то раствор будет кислым. Если же, наоборот, концентрация ионов гидроксила будет больше, чем ионов водорода, то раствор окажется основным. Например, если в растворе концентрация ионов водорода [H+] = 10-4 моль/л, а концентрация ионов гидроксила соответственно равна [OH-] =10-10 моль/л (их произведение должно равняться [H+][OH-]= 10-14), то концентрация ионов водорода больше концентрации ионов гидроксила [H+] > [OH-], и раствор окажется кислым (говорят: среда кислая).
=10-7 моль/л вода является нейтральным электролитом: ни кислым, ни основным. Вода выступает в роли амфолита. Если же концентрация ионов водорода [H+] в водном растворе будет в силу каких-то причин больше концентрации ионов гидроксила [OH-] (например, при добавлении молекул кислоты, распадающихся на ионы водорода и кислотного остатка), то раствор будет кислым. Если же, наоборот, концентрация ионов гидроксила будет больше, чем ионов водорода, то раствор окажется основным. Например, если в растворе концентрация ионов водорода [H+] = 10-4 моль/л, а концентрация ионов гидроксила соответственно равна [OH-] =10-10 моль/л (их произведение должно равняться [H+][OH-]= 10-14), то концентрация ионов водорода больше концентрации ионов гидроксила [H+] > [OH-], и раствор окажется кислым (говорят: среда кислая).
В практической работе принято выражать концентрацию ионов водорода через так называемый водородный показатель рН, который представляет собой просто один только показатель степени концентрации ионов водорода
без отрицательного знака. С математической точки зрения рН ─ это отрицательный десятичный логарифм молярной концентрации ионов водорода: рН = - lg[H+].
Если, например, [H+] = 10-4 моль/л, то рН = - lg[10-4]= 4 (среда кислая). При равных концентрациях ионов водорода и гидроксила [H+] = [OH-] = 10-7моль/л раствор будет нейтральным и его рН = - lg [10-7] = 7 (среда нейтральная). Если рН <7, то среда кислая; если рН > 7, то среда щелочная
Иногда применяют не показатель рН, а показатель ионов гидроксила рОН (по аналогии с рН), равный рОН = -lg[OH-].
Сумма показателей ионов водорода и гидроксила для данного раствора должна быть равной 14, т.е. рН + рОН = 14, так как логарифмирование ионного произведения воды дает следующее соотношение lg ([H+]⋅[OH-]) = lg 10-14, или lg[H+] + lg[OH-] = -14, а отсюда, принимая во внимание, что рН = -lg[H+] и pOH = - lg[OH-], получим рН + рОН = 14.
Следует отметить, что при расчете рН и рОН концентрациями [H+] и [OH-] можно пользоваться лишь в растворах, ионная сила которых близка к нулю, коэффициенты активности единице, а значит активности равны концентрациям. В противном случае ионное произведение воды равно произведению активностей протонов и гидроксид-ионов: Кводы = а (Н+) ∙ а (ОН-).
Так, для растворов с высокой концентрацией электролитов водородный показатель обозначается раН и равен отрицательному логарифму активной (эффективной) концентрации (активности) ионов водорода:: р а Н = -lg([H+] . fH+) = -lg[H+] - lg fH+ = pH - lg fH+ , р а ОН = -lg([ОH-] . fHО-) = -lg[ОH-] - lg fОH- = pОH - lg fОH-, где fH+ ― коэффициент активности протонов в данном растворе.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1405; Нарушение авторских прав?; Мы поможем в написании вашей работы!