
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительные реакции (ОВР). Основные типы ОВР. Типичные окислители и восстановители. Составление уравнений ОВР методом электронного и ионно-электронного баланса
|
|
|
|
Константа гидролиза. Степень гидролиза, связь степени гидролиза с константой гидролиза и концентрацией раствора. Факторы, определяющие глубину гидролиза солей. Совместный гидролиз.
Гидролиз характеризуют степенью гидролиза аг. Это величина, равная отношению числа молекул (или их концентрации Сг), подвергшихся гидролизу, к общему количеству растворенных молекул соли (или их концентрации С): аг = Сг / С.
По существу степень гидролиза представляет собой долю молекул, подвергшихся гидролизу, от общего количества растворенных молекул соли.
Повышение температуры раствора соли во всех случаях приводит к усилению гидролиза, так как гидролиз ― эндотемический процесс (обратный нейтрализации).
Разбавление растворов также смещает равновесие в сторону образования продуктов гидролиза.
К гидролизу, как к равновесному процессу, можно применить закон действующих масс. Например, гидролиз ацетата натрия протекает в соответствии
с уравнением:
NaCH3COO + HOН ↔ NaOH + CH3COOH,
или в ионной форме:
CH3COO- + H+OH- ↔ OH- + CH3COOH.
Константа равновесия Кр для процесса гидролиза запишется в виде выражения:
[CH3COOH] ⋅ [OH−]
Кр = ——————————,
[CH3COO−] ⋅ [H2O]
или, принимая во внимание, что концентрация воды практически остается постоянной величиной,
[CH3COOH] ⋅ [OH−]
Кр⋅ [H2O] = ——————————.
[CH3COO−]
Постоянную величину Кр⋅[H2O] называют константой гидролиза Кг:
[CH3COOH] ⋅ [OH−]
Кг = Кр[H2O] = —————————.
[CH3COO−]
Она не зависит от концентрации ионов в растворе, но зависит от температуры и природы веществ раствора. Последнее выражение константы гидролиза можно
упростить, если умножить числитель и знаменатель выражения на концентрацию ионов водорода [H+], тогда получим следующее выражение:
[OH−] ⋅ [ H+] ∙ [CH3COOH] Kн2о
Кг = —————————————— = —————,
[CH3COO- ] ⋅ [ H+ ] K дис.кислоты
где Kн2о ─ ионное произведение воды, равное [H+]⋅[OH-]; Кдис. кислоты – константа диссоциации кислоты, равная
[CH3COO−] ⋅ [ H+]
Кдис. кислоты = —————————.
[CH3COOH ]
По аналогии для гидролиза соли слабого основания и сильной кислоты (например, NH4Cl) получим:
Kн2о
Кг = —————————,
K дис. основания
где Кдис. основания – константа диссоциации основания.
Таким образом, зная константы диссоциации слабых электролитов (кислоты или основания) и ионное произведение воды, можно рассчитать константы гидролиза соответствующих солей.
Степень аг и константа Кг гидролиза связаны между собой для бинарного электролита соотношением (подобным таковому для степени и константы диссоциации):
Кг = αГ 2С/1−αГ, где С – концентрация соли, моль/л. Обычно степень гидролиза аг значительно
меньше единицы, поэтому приведенное выражение можно упростить: Кг ≈ аг2 С.
Откуда в явном виде степень гидролиза соли равна: аг = 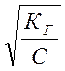 .
.
Принимая во внимание, что константа гидролиза соли определяется через ионное произведение воды и константы диссоцииации слабых электролитов (основания или кислоты, образующихся при гидролизе), можно степень гидро-
лиза представить и в таком виде:
аг = 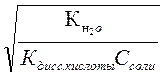 или аг =
или аг = 

Использование вышеприведенных соотношений дает возможность рассчитать и степень гидролиза, и рН раствора соли.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 786; Нарушение авторских прав?; Мы поможем в написании вашей работы!