
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислоты и основания. Влияние положения элемента в периодической системе и степени окисления элемента на состав и кислотно-основные свойства гидроксидов элементов. 3 страница
|
|
|
|
Химическая кинетика или кинетика химических реакций — раздел физической химии, изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.
Реакция нулевого порядка
Кинетическое уравнение имеет следующий вид:
V0 = k0
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения.
Реакция первого порядка
Кинетическое уравнение реакции первого порядка:

Кинетическое уравнение реакции первого порядка:

Приведение уравнения к линейному виду даёт уравнение:
Константа скорости реакции вычисляется как тангенс угла наклона прямой к оси времени:
k1 = − tgα
Период полупревращения:

Реакция второго порядка
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
 или
или 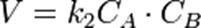
В первом случае скорость реакции определяется уравнением

Линейная форма уравнения:

Константа скорости реакции равна тангенсу угла наклона прямой к оси времени:
k2 = − tgα
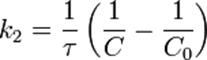
Во втором случае выражение для константы скорости реакции будет выглядеть так:

Период полупревращения (для случая равных начальных концентраций!):

Молекулярность реакции
Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.):
H2S → H2 + S
Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных):
СН3Вr + КОН → СН3ОН + КВr
Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трех частиц:
О2 + NО + NО → 2NО2
Реакции с молекулярностью более трёх неизвестны.
Для элементарных реакций, проводимых при близких концентрациях исходных веществ, величины молекулярности и порядка реакции совпадают. Чётко определенной взаимосвязи между понятиями молекулярности и порядка реакции нет, так как порядок реакции характеризует кинетическое уравнение реакции, а молекулярность — механизм реакции.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 483; Нарушение авторских прав?; Мы поможем в написании вашей работы!