
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Окислительно-восстановительными называются реакции, в результате которых изменяются степени окисления атомов химических элементов, входящих в состав реагирующих веществ
|
|
|
|
Окисление - это процесс отдачи атомом электронов, сопровождающийся повышением его степени окисления. Присоединение атомом электронов, приводящее к понижению его степени окисления, называется восстановлением.
Окислительно-восстановительные реакции подразделяются на следующие виды:
а) межмолекулярного окисления-восстановления, т. е. реакции, в которых окислитель и восстановитель входят в состав разных веществ (Fe0 + 2H+Cl = Fe+2Cl2 + H02 );
б)диспропорционирования, т. е. реакции, которые идут с изменением степени окисления атомов одного и того же элемента (Cl20 + 2KOH = KCl- + KCl+O + H2O);
в) внутримолекулярные, т. е. реакции, в которых атомы различных элементов, изменяющие свои степени окисления, входят в состав одного соединения
(N-3H4N+3 O2 = N20 + 3H2O).
Типичные восстановители: металлы, водород, уголь, окись углерода (II) (CO), сероводород (H2S); оксид серы (IV) (SO2); сернистая кислота H2SO3 и ее соли, галогеноводородные кислоты и их соли, катионы металлов в низших степенях окисления: SnCl2, FeCl2, MnSO4, Cr2(SO4)3; азотистая кислота HNO2; аммиак NH3; гидразин NH2NH2; оксид азота(II) (NO); Катод при электролизе.
Типичные окислители: галогены, перманганат калия(KMnO4); манганат калия (K2MnO4); оксид марганца (IV) (MnO2), дихромат калия (K2Cr2O7);
хромат калия (K2CrO4), азотная кислота (HNO3), серная кислота (H2SO4) конц, оксид меди(II) (CuO); оксид свинца(IV) (PbO2); оксид серебра (Ag2O); пероксид водорода (H2O2), хлорид железа(III) (FeCl3), бертоллетова соль (KClO3), анод при электролизе.
Составление ОВР методом электронного баланса:
Электронный баланс - метод нахождения коэффициентов в уравнениях окислительно-восстановительных реакций, в котором рассматривается обмен электронами между атомами элементов, изменяющих свою степень окисления. Число электронов, отданное восстановителем равно числу электронов, получаемых окислителем.
Уравнение составляется в несколько стадий:
1. Записывают схему реакции.
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
2. Проставляют степени окисления над знаками элементов, которые меняются.
KMn+7O4 + HCl-1 → KCl + Mn+2Cl2 + Cl20 + H2O
3. Выделяют элементы, изменяющие степени окисления и определяют число электронов, приобретенных окислителем и отдаваемых восстановителем.
Mn+7 + 5ē = Mn+2
2Cl-1 - 2ē = Cl20
4. Уравнивают число приобретенных и отдаваемых электронов, устанавливая тем самым коэффициенты для соединений, в которых присутствуют элементы, изменяющие степень окисления.
Mn+7 + 5ē = Mn+2 2
2Cl-1 - 2ē = Cl20 5
––––––––––––––––––––––––
2Mn+7 + 10Cl-1 = 2Mn+2 + 5Cl20
5. Подбирают коэффициенты для всех остальных участников реакции. При этом 10 молекул HCl участвуют в восстановительном процессе, а 6 в - ионообменном (связывание ионов калия и марганца).
2KMn+7O4 + 16HCl-1 = 2KCl + 2Mn+2Cl2 + 5Cl20 + 8H2O
Составление ОВР методом ионно-электронного баланса:
1. Записывают схему реакции.
K2SO3 + KMnO4 + H2SO4 → K2SO4 + MnSO4 + H2O
2. Записывают схемы полуреакций, с использованием реально присутствующих частиц (молекул и ионов) в растворе. При этом подводим материальный баланс, т.е. количество атомов элементов участвующих в полуреакции в левой части должно быть равно их количеству в правой. В зависимости от характера среды используют следующие правила стягивания избыточных ионов водорода и кислорода:
а. Избыточные ионы кислорода (О) в кислой среде образуют (стягивают) с ионами Н малодиссоциированные молекулы воды:
О + 2Н = Н2О.
б. Избыточные ионы кислорода в нейтральной или щелочной среде стягиваются с молекулами воды, образуя ОН группы:
О + НОН = 2ОН.
в. Избыточные ионы водорода (Н) в щелочной среде стягиваются с ионами ОН, образуя молекулы воды:
Н + ОН = Н2О
г. Недостающие ионы кислорода (О) в кислой и нейтральной средах берутся из молекул воды с образованием ионов Н:
Н2О – О = 2Н.
д. Недостающие ионы кислорода (О) в щелочной среде берутся из групп ОН с образованием молекул Н2О:
2ОН - О = Н2О.
е. Недостающие ионы Н в щелочной среде берутся из молекул воды с образованием ионов гидроксила:
Н2О – Н = ОН
MnO4- + 8H+ → Mn2+ + 4H2O восстановление
SO32- + H2O → SO42- + 2H+ окисление
3. Подводим электронный баланс, следуя необходимости равенства суммарного заряда в правой и левой частях уравнений полуреакций.
В приведенном примере в правой части уравнения полуреакции восстановления суммарный заряд ионов равен +7, в левой — +2, значит в правой части необходимо добавить пять электронов:
MnO4- + 8H+ + 5ē → Mn2+ + 4H2O
В уравнении полуреакции окисления суммарный заряд в правой части равен -2, в левой 0, значит в правой части необходимо вычесть два электрона:
SO32- + H2O – 2ē → SO42- + 2H+
Таким образом, в обоих уравнениях осуществлен ионно-электронный баланс и можно в них вместо стрелок поставить знаки равенства:
MnO4- + 8H+ + 5ē = Mn2+ + 4H2O
SO32- + H2O – 2ē = SO42- + 2H+
4. Следуя правилу о необходимости равенства количества электронов принятых окислителем и отданных восстановителем, находим наименьшее общее кратное для количеств электронов в обоих уравнениях (2∙5 = 10).
MnO4- + 8H+ + 5ē = Mn2+ + 4H2O 2
SO32- + H2O – 2ē = SO42- + 2H+ 5
5. Умножаем на коэффициенты (2,5) и суммируем оба уравнения.
MnO4- + 8H+ + 5ē = Mn2+ + 4H2O 2
SO32- + H2O – 2ē = SO42- + 2H+ 5
––––––––––––––––––––––––––––––––––––––––––––––
2MnO4- + 16H+ + 5SO32- + 5H2O = 2Mn2+ + 8H2O + 5SO42- + 10H+
или, суммируя (вычитая) одинаковые молекулы и ионы, получаем:
2MnO4- + 6H+ + 5SO32- = 2Mn2+ + 3H2O + 5SO42-
или в молекулярной форме:
5K2SO3 + 2KMnO4 + 3H2SO4 = 6K2SO4 + 2MnSO4 + 3H2O
В этом методе рассматривают переход электронов от одних атомов или ионов к другим с учетом характера среды (кислая, щелочная или нейтральная), в которой протекает реакция.
Электродный потенциал. Понятие о двойном электрическом слое и скачке потенциала на границе металл-раствор соли металла. Водородный электрод как электрод сравнения. Схема измерения электродного потенциала. Стандартные электродные потенциалы для металлов (ряд напряжений металлов). Уравнение Нернста.
Ряд стандартных электродных потенциалов: Если пластинку металла, погруженную в раствор его соли с концентрацией ионов металла, равной 1 моль/л, соединить со стандартным водородным электродом, то получится гальванический элемент. Электродвижущая сила этого элемента (ЭДС), измеренная при 25 °С, и характеризует стандартный электродный потенциал металла, обозначаемый обычно как Е° или φ°.
Стандартные потенциалы электродов, выступающих как восстановители по отношению к водороду, имеют знак “-”, а знак “+” имеют стандартные потенциалы электродов, являющихся окислителями.
Металлы, расположенные в порядке возрастания их стандартных электродных потенциалов, образуют так называемый электрохимический ряд напряжений металлов: Li, Rb, К, Ва, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb, H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Значение стандартного электродного потенциала водородного электрода, являющегося электродом сравнения и соответствующего процессу: 2Н+ + 2е = Н2, принято равным нулю.
Ряд напряжений характеризует химические свойства металлов:
1. Чем более отрицателен электродный потенциал металла, тем больше его восстановительная способность.
2. Каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые стоят в электрохимическом ряду напряжений металлов после него.
3. Все металлы, имеющие отрицательный стандартный электродный потенциал, т. е. находящиеся в электрохимическом ряду напряжений металлов левее водорода, способны вытеснять его из растворов кислот.
Как и в случае определения значения Е° металлов, значения Е° неметаллов измеряются при температуре 25 °С и при концентрации всех атомных и молекулярных частиц, участвующих в равновесии, равной 1 моль/л.
Алгебраическое значение стандартного окислительно-восстановительного потенциала характеризует окислительную активность соответствующей окисленной формы.
Величина электродного потенциала окислительно-восстановительной системы зависит от концентрации окисленной и восстановленной формы и температуры. Эта зависимость выражается уравнением Нернста:
Е(Ox/Red) = Е°(Ox/Red) + 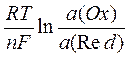 , где
, где
Е(Ox/Red) - искомый потенциал окислительно-восстановительной системы (в вольтах)
Е°(Ox/Red) - ее стандартный потенциал
R – универсальная газовая постоянная (8,324 Дж/моль∙К)
T – абсолютная температура
F – постоянноя Фарадея (96485 Кл/моль)
n – количество электронов передаваемых от окисленной формы к восстановленной
a(Ox) и a(Red) активности окисленной и восстановленной формы соответственно. В случае разбавленных растворов (ионная сила растворов близка к нулю) вместо активностей можно использовать их молярные концентрации:
Е(Ox/Red) = Е°(Ox/Red) + 
При температуре Т = 298° К, подставляя численные значения R и F, используя десятичный логарифм вместо натурального (ln(a) = 2,3∙lg(a)) получаем:
Е(Ox/Red) = Е°(Ox/Red) + 
Для системы металл/раствор соли данного металла с учетом того, что активность гетерофазы [Red] величина постоянная и равна единице уравнение принимает вид:
Е(Меn+/Me) = Е°(Меn+/Ме) +  ∙ ln[Меn+] = Е°(Меn+/Ме) +
∙ ln[Меn+] = Е°(Меn+/Ме) + 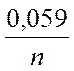 ∙ ln[Меn+]
∙ ln[Меn+]
Если в уравнение полуреакции входит протон или гидроксид-ион, то величина электродного потенциала зависит и от рН среды.
Например, для полуреакции: МnО4- +8Н+ + 5е- = Мn2+ + 4Н2О потенциал рассчитывается по формуле:
 Как уже отмечалось, для водных растворов в качестве стандартного электрода обычно используют водородный электрод (Pt, Н2[0,101 МПа] | Н+[a= 1]), потенциал которого при давлении водорода 0,101 МПа и термодинамич. активности а ионов Н+ в растворе, равной 1, принимают условно равным нулю (водородная шкала Э. п.).
Как уже отмечалось, для водных растворов в качестве стандартного электрода обычно используют водородный электрод (Pt, Н2[0,101 МПа] | Н+[a= 1]), потенциал которого при давлении водорода 0,101 МПа и термодинамич. активности а ионов Н+ в растворе, равной 1, принимают условно равным нулю (водородная шкала Э. п.).
Величина потенциала любого водородного электрода (соответствующего полуреакции 2Н+ + 2е = Н2), принимая активность водорода (Н2) равной единице, рассчитывается по формуле:
Е(Н+/Н2) = Е0 (Н+/Н2) + 0,059 ∙ lg[H+].
С учетом того, что стандартный потенциал Е0 (Н+/Н2) равен нулю, а lg[H+] = -рН получаем:
Е(Н+/Н2) = - 0,059 ∙ рН.
Процессы коррозии и другие процессы окисления протекающие под действием атмосферного кислорода и воды соответствуют полуреакции:
О2 + 4Н+ + 4е = 2Н2О Е0 = 1,228 В.
Уравнение Нернста для этого процесса:
Е = Е0 +0,059 ∙ lg[H+] + (0,059/4) ∙ lgP(O2), или Е = Е0 - 0,059 ∙ рН + (0,059/4) ∙ lgP(O2)
где P(O2) – парциальное давление кислорода. Если парциальное давление кислорода равно одной атмосфере, то уравнение принимает вид:
Е = Е0 - 0,059 ∙ рН
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 794; Нарушение авторских прав?; Мы поможем в написании вашей работы!