
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кислоты и основания. Влияние положения элемента в периодической системе и степени окисления элемента на состав и кислотно-основные свойства гидроксидов элементов. 2 страница
|
|
|
|
Нейтральные комплексы: Названия комплексов без внешней сферы состоят из одного слова. Вначале указывается число и названия лигандов (для лигандов каждого вида отдельно), затем название центрального атома в именительном падеже (в случае многоядерных комплексов – с указанием числа центральных атомов).
Например:
[Al2Cl6] – гексахлородиалюминий
[Co2(CO)8] – октакарбонилдикобальт
[Fe(C5H5)2] – бис(циклопентадиенил)железо
[Mo6Cl14] – 14-хлорогексамолибден
[Ni(CO)4] – тетракарбонилникель
[Zn(py)2Cl2] –дихлоробис(пиридин)цинк
Комплексные катионы: Названия соединений с комплексными катионами строятся так же, как и названия простых соединений, состоящих из катиона и аниона (т.е. "анион катиона", например NaCl - хлорид натрия, BaCrO4 - хромат бария, H2O2 - пероксид водорода и т.п.). Однако в рассматриваемом случае катион не простой, а комплексный.
Названия комплексных катионов состоят из числа и названия лигандов и названия комплексообразователя (для многоядерных комплексов – с указанием их числа). Обозначение степени окисления комплексообразователя дают римскими цифрами в скобках после названия (по способу Штока):
[Ag(NH3)2]+ - катион диамминсеребра(I)
[Cr2(NH3)9(OH)2]4+ - катион дигидроксононаамминдихрома(III)
[Mn(H2O)6]2+ - катион гексааквамарганца(II)
[Pt(en)2]2+ - катион бис(этилендиамин)платины(II)
В случае неизвестной степени окисления комплексообразователя указывают заряд всего катиона в скобках арабскими цифрами (по способу Эвенса – Бассетта). Например:
[Hg2(H2O)2]2+ - катион диаквадиртути(2+)
[Nb6Cl12]+ - катион додекахлорогексаниобия(1+)
Названия соединений, включающих комплексный катион, строятся следующим образом:
[Hg2(H2O)2](NO3)2 – нитрат диаквадиртути(2+)
[Mn(H2O)6] SO4 - сульфат гексааквамарганца(II)
[Ag(NH3)2]OH - гидроксид диамминсеребра(I)
[Cr2(NH3)9(OH)2]Cl4 - хлорид дигидроксононаамминдихрома(III)
Комплексные анионы: Названия соединений с комплексными анионами строятся так же, как названия простых соединений, состоящих из катиона и аниона (т.е. "анион катиона", например NaCl - хлорид натрия, BaCrO4 - хромат бария, H2O2 - пероксид водорода и т.п.). Однако в рассматриваемом случае анион не простой, а комплексный.
Название комплексного аниона строится из числа и названия лигандов, корня названия элемента-комплексообразователя, суффикса -ат и указания степени окисления комплексообразователя:
[BF4]- - тетрафтороборат(III)-ион
[Al(H2O)2(OH)4]- - тетрагидроксодиакваалюминат(III)-ион
[VS4]3- - тетратиованадат(V)-ион
Для целого ряда элементов-комплексообразователей вместо русских используются корни их латинских названий: Ag - аргент-; Au - аур-; Cu - купр-; Fe - ферр-; Hg - меркур-; Mn - манган-; Ni - никкол-; Pb - плюмб-; Sb - стиб-; Sn - станн-.
Примеры названий комплексных анионов:
[Fe(CN)6]3- - гексацианоферрат(III)-ион
[Ag(SO3S)2]3- - бис(тиосульфато)аргентат(I)-ион
Названия соединений, включающих комплексный анион, строятся следующим образом:
K2[HgI4] – тетраиодомеркурат(II) калия
H[Sb(OH)6] - гексагидроксостибат(V) водорода
Na[Ag(CN)2] - дицианоаргентат(I) натрия
(NH4)2[PtCl6] - тетрахлороплатинат(IV) аммония
K3[AlF6] – гексафтороалюминат(III) калия
Мостиковые группы и многоядерные комплексы: Названию мостиковых групп предшествует греческая буква m (мю), которая повторяется перед названием мостикового лиганда каждого вида. При перечислении лигандов сначала называют мостиковые в порядке их усложнения, затем немостиковые в полном соответствии с ранее установленным порядком, а после этого – комплексообразователи с указанием их числа. Если в комплексе имеются одинаковые фрагменты, это тоже может быть отражено в названии. Примеры:
[(NH3)5Co – NH2 – Co(NH3)5]Cl5
хлорид (m-амидо)-декаамминдикобальта(III) или
хлорид (m-амидо)-бис{пентаамминкобальта(III)}
Геометрические изомеры: Для различия геометрических изомеров к названию комплексных соединений добавляют приставку цис-, если одинаковые по составу лиганды занимают соседнее положение по отношению к комплексообразователю, или транс-, когда лиганды находятся в противоположных положениях.
Оксиды – соединения элемента с кислородом, имеющим степень окисления –2. Общая формула ЭmOn.
Оксиды не образующие кислот, оснований и солей при обычных условиях, называются не солеобразующими.
Солеобразующие оксиды подразделяются на кислотные, основные и амфотерные (обладающие двойственными свойствами). Неметаллы образуют только кислотные оксиды, металлы – все остальные и некоторые кислотные.
Кислотным гидроксидам (H2SO4, H2CO3) отвечают кислотные оксиды (SO3, CO2), а основным гидроксидам (NaOH, Ca(OH)2) основные оксиды (Na2O, CaO), причем степень окисления элемента Е не изменяется при переходе от гидроксида к оксиду.
Химические свойства:
Основные оксиды Кислотные оксиды
1. Взаимодействие с водой
Образуется основание: Образуется кислота:
Na2O + H2O = 2NaOH SO3 + H2O = H2SO4
CaO + H2O = Ca(OH)2 P2O5 + 3H2O = 2H3PO4
2. Взаимодействие с кислотой или основанием:
При реакции с кислотой При реакции с основанием
образуется соль и вода образуется соль и вода
MgO+H2SO4–t°=MgSO4+H2O CO2+Ba(OH)2=BaCO3+H2O
CuO + 2HCl –t°= CuCl2 + H2O SO2+2NaOH=Na2SO3 +H2O
Амфотерные оксиды взаимодействуют
с кислотами как основные:
ZnO + H2SO4 = ZnSO4 + H2O
с основаниями как кислотные:
ZnO + 2NaOH = Na2ZnO2 + H2O
(ZnO + 2NaOH + H2O = Na2[Zn(OH)4])
3. Взаимодействие основных и кислотных оксидов между собой приводит к солям.
Na2O + CO2 = Na2CO3
4. Восстановление до простых веществ:
3CuO + 2NH3 = 3Cu + N2 + 3H2O
P2O5 + 5C = 2P + 5CO
Амфотерность гидроксидов и оксидов химическое свойство, заключающееся в образовании ими двух рядов солей, например, для гидроксида и оксида алюминия:
(а) 2Al(OH)3 + 3SO3 = Al2(SO4)3 + 3H2O
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O
(б) 2Al(OH)3 + Na2O = 2NaAlO2 + 3H2O
Al2O3 + 2NaOH = 2NaAlO2 + H2O
Так, гидроксид и оксид алюминия в реакциях (а) проявляют свойства основных гидроксидов и оксидов, т.е. реагируют с кислотными гидроксидам и оксидом, образуя соответствующую соль сульфат алюминия Al2(SO4)3, тогда как в реакциях (б) они же проявляют свойства кислотных гидроксидов и оксидов, т.е. реагируют с основными гидроксидом и оксидом, образуя соль диоксоалюминат (III) натрия NaAlO2. В первом случае элемент алюминий проявляет свойство металла и входит в состав электроположительной составляющей (Al3+), во втором свойство неметалла и входит в состав электроотрицательной составляющей формулы соли (AlO2).
Если указанные реакции протекают в водном растворе, то состав образующихся солей меняется, но присутствие алюминия в катионе и анионе остаётся:
2Al(OH)3 + 3H2SO4 = [Al(H2O)6]2(SO4)3
Al(OH)3 + NaOH = Na[Al(OH)4]
Здесь квадратными скобками выделены комплексные ионы [Al(H2O)6]3+ - катион гексаакваалюминия(III), [Al(OH)4] - тетрагидроксоалюминат(III)-ион. Элементы, проявляющие в соединениях металлические и неметаллические свойства, называют амфотерными, к ним относятся элементы А-групп Периодической системы Be, Al, Ga, Ge, Sn, Pb, Sb, Bi, Po и др., а также большинство элементов Б-групп Cr, Mn, Fe, Zn, Cd, Au и др. Амфотерным оксидам не всегда соответствуют амфотерные гидроксиды, поскольку при попытке получения последних образуются гидратированные оксиды. Если амфотерному элементу в соединениях отвечает несколько степеней окисления, то амфотерность соответствующих оксидов и гидроксидов (а следовательно, и амфотерность самого элемента) будет выражена по-разному. Для низких степеней окисления у гидроксидов и оксидов наблюдается преобладание основных свойств, а у самого элемента металлических свойств, поэтому он почти всегда входит в состав катионов. Для высоких степеней окисления, напротив, у гидроксидов и оксидов наблюдается преобладание кислотных свойств, а у самого элемента неметаллических свойств, поэтому он почти всегда входит в состав анионов. Так, у оксида и гидроксида марганца(II) доминируют основные свойства, а сам марганец входит в состав катионов типа [Mn(H2O)6]2+, тогда как у оксида и гидроксида марганца(VII) доминируют кислотные свойства, а сам марганец входит в состав аниона типа MnO4. Амфотерным гидроксидам с большим преобладанием кислотных свойств приписывают формулы и названия по образцу кислотных гидроксидов, например НMnVIIO4 марганцовая кислота. Таким образом, деление элементов на металлы и неметаллы условное; между элементами (Na, K, Ca, Ba и др.) с чисто металлическими и элементами (F, O, N, Cl, S, C и др.) с чисто неметаллическими свойствами существует большая группа элементов с амфотерными свойствами.
Форма гидроксидов с х ОН.Общая формула Э(ОН)х, где х = 1и 2, содержащая больше атомов кислорода и водорода, называется орто-формой, А форма с меньшим числом – мета-формой.
Основания – сложные вещества, молекулы которых состоят из атома металла (или иона NH4+) и одной или нескольких гидроксогрупп ОН, способных замещаться на кислотный остаток. Общая формула оснований Ме(ОН)х, где х – степень окисления металла.
Кислоты – сложные вещества, содержащие атомы водорода, которые могут замещаться катионами металла (или ионами аммония). Общая формула кислот НхАn.
Соли – продукты замещения (полного или частичного) атомов водорода в молекулах кислот катионами металла (а также ионами аммония), либо гидроксогрупп в молекулах оснований кислотными остатками.
Соли делятся на средние, кислые, основные, двойные, смешанные и комплексные. Средние соли – это продукт полного замещения атомов водорода. МехAny.
Кислотные соли – это продукт не полного замещения атомов водорода в молекулах только многоосновных кислот.
Основные соли – продукт неполного замещения гидроксогрупп в молекулах только многокислотных оснований кислотными остатками.
Двойные соли – содержит два химически разных катиона и один тип аниона.
Смешанные соли – содержат один тип катиона, но два типа аниона.
В состав комплексных солей входят сложные комплексные ионы (заключённые в квадратные скобки), устойчивые как в кристаллическом состоянии, так и при растворении в воде.
Название средней соли = Название кислотного остатка + Название металла (р.п.) + Степень окисления металла.
Кислотные и основные гидроксиды. Соли
Гидроксиды тип сложных веществ, в состав которых входят атомы некоторого элемента Е (кроме фтора и кислорода) и гидроксогруппы ОН; общая формула гидроксидов Е(ОН) n, где n = 1÷6. Форма гидроксидов Е(ОН) n называется орто -формой; при n > 2 гидроксид может находиться также в мета -форме, включающей кроме атомов Е и групп ОН еще атомы кислорода О, например Е(ОН)3 и ЕО(ОН), Е(ОН)4 и Е(ОН)6 и ЕО2(ОН)2.
Гидроксиды делят на две противоположные по химическим свойствам группы: кислотные и основные гидроксиды. Кислотные гидроксиды содержат атомы водорода, которые могут замещаться на атомы металла при соблюдении правила стехиометрической валентности. Большинство кислотных гидроксидов находится в мета -форме, причем атомы водорода в формулах кислотных гидроксидов ставят на первое место, например H2SO4, HNO3 и H2CO3, а не SO2(OH)2, NO2(OH) и CO(OH)2. Общая формула кислотных гидроксидов Н х ЕО у, где электроотрицательную составляющую ЕО ух называют кислотным остатком. Если не все атомы водорода замещены на металл, то они остаются в составе кислотного остатка.
Названия распространенных кислотных гидроксидов состоят из двух слов: собственного названия с окончанием “ая” и группового слова “кислота”. Названия кислотных остатков используют при построении названий солей.
Кислоты - сложные вещества, состоящие из атомов водорода и кислотного остатка. (С точки зрения теории электролитической диссоциации: кислоты - электролиты, которые при диссоциации в качестве катионов образуют только H+).
Классификация
1. По составу: бескислородные и кислородсодержащие.
2. По числу атомов водорода, способных замещаться на металл: одно-, двух-, трёхосновные...
Бескислородные:
HCl - хлористоводородная (соляная), одноосновная, хлорид
HBr – бромистоводородная, одноосновная, бромид
HI – йодистоводородная, одноосновная, йодид
H2S – сероводородная, двухосновная. сульфид
Кислородсодержащие:
HNO3 – азотная, одноосновная, нитрат.
H2SO3 – сернистая, двухосновная, сульфит.
H2SO4 – серная, двухосновная, сульфат.
H2CO3 – угольная, двухосновная, карбонат.
H2SiO3 – кремниевая, двухосновная, силикат.
H3PO4 – ортофосфорная, трёхосновная,ортофосфат.
Получение:
1. Взаимодействие кислотного оксида с водой (для кислородсодержащих кислот):
SO3 + H2O = H2SO4
P2O5 + 3H2O = 2H3PO4
2. Взаимодействие водорода с неметаллом и последующим растворением полученного продукта в воде (для бескислородных кислот):
H2 + Cl2 = 2HCl
H2 + S = H2S
3. Реакциями обмена соли с кислотой
Ba(NO3)2 + H2SO4 = BaSO4¯ + 2HNO3
в том числе, вытеснение слабых, летучих или малорастворимых кислот из солей более сильными кислотами:
Na2SiO3 + 2HCl = H2SiO3 + 2NaCl
2NaCl(тв.) + H2SO4(конц.) –t°® Na2SO4 + 2HCl
Химические свойства
1. Действие на индикаторы.
лакмус - красный
метилоранж - розовый
2. Взаимодействие с основаниями (реакция нейтрализации):
H2SO4 + 2KOH = K2SO4 + 2H2O
2HNO3 + Ca(OH)2 = Ca(NO3)2 + 2H2O
3. Взаимодействие с основными оксидами:
CuO + 2HNO3 –t°= Cu(NO3)2 + H2O
4. Взаимодействие с металлами:
Zn + 2HCl = ZnCl2 + H2
2Al + 6HCl= 2AlCl3 + 3H2
(металлы, стоящие в ряду напряжений до водорода, кислоты-неокислители).
5. Взаимодействие с солями (реакции обмена), при которых выделяется газ или образуется осадок:
H2SO4 + BaCl2 = BaSO4 +2HCl
2HCl + K2CO3 = 2KCl + H2O + CO2
Основные гидроксиды содержат гидроксид-ионы, которые могут замещаться на кислотные остатки при соблюдении правила стехиометрической валентности. Все основные гидроксиды находятся в орто -форме; их общая формула М(ОН) n, где n = 1,2 (реже 3,4) и М n + катион металла.
Получение:
1. Реакции активных металлов (щелочных и щелочноземельных металлов) с водой:
2Na + 2H2O = 2NaOH + H2
Ca + 2H2O = Ca(OH)2 + H2
2. Взаимодействие оксидов активных металлов с водой:
BaO + H2O = Ba(OH)2
3. Электролиз водных растворов солей
2NaCl + 2H2O = 2NaOH + H2 + Cl2
Химические свойства:
Щёлочи. Нерастворимые основания
1. Действие на индикаторы.
лакмус - синий
метилоранж - жёлтый
фенолфталеин - малиновый
2. Взаимодействие с кислотными оксидами.
2KOH + CO2 = K2CO3 + H2O
KOH + CO2 = KHCO3
3. Взаимодействие с кислотами (реакция нейтрализации) с образованием солей (реакция солеобразования), например:
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
Ca(OH)2 + 2H2SO4 = Ca(HSO4)2 + 2H2O
2Ca(OH)2 + H2SO4 = Ca2SO4(OH)2 + 2H2O
NaOH + HNO3 = NaNO3 + H2O
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
4. Обменная реакция с солями
Ba(OH)2 + K2SO4 = 2KOH + BaSO4
3KOH+Fe(NO3)3 = Fe(OH)3 + 3KNO3
5. Термический распад.
Cu(OH)2 –t°= CuO + H2O
Соли тип сложных веществ, в состав которых входят катионы М n + и кислотные остатки*. Соли с общей формулой М х (ЕО у) n называют средними солями, а соли с незамещенными атомами водорода, кислыми солями. Иногда соли содержат в своем составе также гидроксид или(и) оксид ионы; такие соли называют основными солями. Кислые и основные соли могут быть превращены в средние соли взаимодействием с соответствующим основным и кислотным гидроксидом, например:
Ca(HSO4)2 + Ca(OH) = CaSO4 + 2H2O
Ca2SO4(OH)2 + H2SO4 = 2CaSO4 + 2H2O
Соли - сложные вещества, которые состоят из атомов металла и кислотных остатков. Это наиболее многочисленный класс неорганических соединений.
Классификация
СОЛИ бывают: средние,кислые,основные,двойные,смешанные,комплексные
Средние. При диссоциации дают только катионы металла (или NH4+)
Na2SO4 → 2Na+ +SO42-
CaCl2 → Ca2+ + 2Cl-
Кислые. При диссоциации дают катионы металла (NH4+), ионы водорода и анионы кислотного остатка.
NaHCO3 → Na+ + HCO3- → Na+ + H+ + CO32-
Продукты неполного замещения атомов водорода многоосновной кислоты на атомы металла.
Основные. При диссоциации дают катионы металла, анионы гидроксила и кислотного остатка.
Zn(OH)Cl → [Zn(OH)]+ + Cl- → Zn2+ + OH- + Cl-
Продукты неполного замещения групп OH соответствующего основания на кислотные остатки.
Двойные. При диссоциации дают два катиона и один анион.
KAl(SO4)2 → K+ + Al3+ + 2SO42-
Смешанные. Образованы одним катионом и двумя анионами:
CaOCl2 → Ca2+ + Cl- + OCl-
Комплексные. Содержат сложные катионы или анионы.
[Ag(NH3)2]Br → [Ag(NH3)2]+ + Br -
Na[Ag(CN)2] → Na+ + [Ag(CN)2]-
Средние соли .Получение:
Большинство способов получения солей основано на взаимодействии веществ с противоположными свойствами:
1) металла с неметаллом: 2Na + Cl2 = 2NaCl
2) металла с кислотой: Zn + 2HCl = ZnCl2 + H2
3) металла с раствором соли менее активного металла
Fe + CuSO4 = FeSO4 + Cu
4) основного оксида с кислотным оксидом:
MgO + CO2 = MgCO3
5) основного оксида с кислотой
CuO + H2SO4 –t°= CuSO4 + H2O
6) основания с кислотным оксидом
Ba(OH)2 + CO2 = BaCO3 + H2O
7) основания с кислотой:
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
8) соли с кислотой:
MgCO3 + 2HCl = MgCl2 + H2O + CO2
BaCl2 + H2SO4 = BaSO4 + 2HCl
9) раствора основания с раствором соли:
Ba(OH)2 + Na2SO4 = 2NaOH + BaSO4
10) растворов двух солей
3CaCl2 + 2Na3PO4 = Ca3(PO4)2 + 6NaCl
Химические свойства:
1. Термическое разложение.
CaCO3 = CaO + CO2
2Cu(NO3)2 = 2CuO + 4NO2 + O2
NH4Cl = NH3 + HCl
2. Гидролиз.
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
FeCl3 + H2O = Fe(OH)Cl2 + HCl
Na2S + H2O = NaHS +NaOH
3. Обменные реакции с кислотами, основаниями и другими солями.
AgNO3 + HCl = AgCl + HNO3
Fe(NO3)3 + 3NaOH = Fe(OH)3 + 3NaNO3
CaCl2 + Na2SiO3 = CaSiO3 + 2NaCl
4. Окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона.
2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2 + 8H2O
Кислые соли. Получение:
1. Взаимодействие кислоты с недостатком основания.
KOH + H2SO4 = KHSO4 + H2O
2. Взаимодействие основания с избытком кислотного оксида
Ca(OH)2 + 2CO2 = Ca(HCO3)2
3. Взаимодействие средней соли с кислотой
Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2
Химические свойства:
1. Термическое разложение с образованием средней соли
Ca(HCO3)2 = CaCO3 + CO2 + H2O
2. Взаимодействие со щёлочью. Получение средней соли.
Ba(HCO3)2 + Ba(OH)2 = 2BaCO3 + 2H2O
Основные соли.Получение:
1. Гидролиз солей, образованных слабым основанием и сильной кислотой
ZnCl2 + H2O = [Zn(OH)]Cl + HCl
2. Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов
AlCl3 + 2NaOH = [Al(OH)2]Cl + 2NaCl
3. Взаимодействие солей слабых кислот со средними солями
2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3 + CO2 + 4NaCl
Химические свойства:
1. Термическое разложение.
[Cu(OH)]2CO3(малахит) = 2CuO + CO2 + H2O
2. Взаимодействие с кислотой: образование средней соли.
Sn(OH)Cl + HCl = SnCl2 + H2O
Понятие о механизме химических реакций. Простые и сложные реакции, применение закона действия масс к простым и сложным реакциям. Кинетический порядок и молекулярность реакций. Цепные реакции: зарождение, развитие, и обрыв цепи (на примере неразветвленной цепной реакции водорода и хлора)
Понятие о механизме химической реакции
Механизм реакции - детальное ее описание с учетом всех промежуточных стадий и промежуточных веществ, природы взаимодействия реагирующих частиц, характера разрыва связей, изменения энергии химической системы на всем пути ее перехода из исходного в конечное состояние. Цель изучения механизма реакции - возможность управлять ходом реакции, ее направлением и эффективностью.
Реакции, протекающие в одну стадию, называют простыми (элементарными) реакциями, а реакции, включающие несколько стадий - сложными. Многие органические реакции являются сложными и идут в несколько элементарных стадий (последовательных или параллельных). Общая скорость сложной химической реакции определяется скоростью ее наиболее медленной (лимитирующей) стадии.
В случае сложных реакций на некоторых стадиях образуются нестабильные промежуточные частицы - органические ионы или свободные радикалы. Их относительная устойчивость и, следовательно, вероятность образования растут с увеличением возможности делокализации (рассредоточения) заряда в ионе или неспаренного электрона в радикале.
Зако́нде́йствующих масс: соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.
Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции. Для элементарной химической реакции:

закон действующих масс может быть записан в виде кинетического уравнения вида:

где 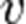 — скорость химической реакции,
— скорость химической реакции,  — константа скорости реакции.
— константа скорости реакции.
Для сложных реакций в общем виде это соотношение не выполняется. Тем не менее, многие сложные реакции условно можно рассматривать как ряд последовательных элементарных стадий с неустойчивыми промежуточными продуктами, формально эквивалентный переходу из начального состояния в конечное в. Такие реакции называют формально простыми. Для формально простых реакций кинетическое уравнение может быть получено в виде:

(для трех исходных веществ, аналогично приведённому выше уравнению). Здесь 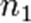 ,
,  ,
, 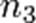 — порядок реакции по веществам
— порядок реакции по веществам  ,
, 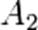 ,
, 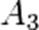 соответственно, а сумма
соответственно, а сумма 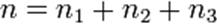 — общий (или суммарный) порядок реакции.
— общий (или суммарный) порядок реакции.  ,
,  ,
,  могут быть не равны стехиометрическим коэффициентам и не обязательно целочисленные. при определённых условиях может быть равно и нулю.
могут быть не равны стехиометрическим коэффициентам и не обязательно целочисленные. при определённых условиях может быть равно и нулю.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1011; Нарушение авторских прав?; Мы поможем в написании вашей работы!