
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства алканов ?
3?
4 Молекула органического соединения представляет собой совокупность атомов, связанных в определенном порядке, как правило, ковалентными связями. При этом связанные атомы могут различаться по величине электроотрицательности. Величины электроотрицательностей в значительной степени определяют такие важнейшие характеристики связи, как полярность и прочность (энергия образования). В свою очередь, полярность и прочность связей в молекуле, в значительной степени, определяют возможности молекулы вступать в те или иные химические реакции.
Электроотрицательность атома углерода зависит от состояния его гибридизации. Это связано с долей s-орбитали в гибридной орбитали: она меньше у sp3- и больше у sp2- и sp-гибридных атомов.
Все составляющие молекулу атомы находятся во взаимосвязи и испытывают взаимное влияние. Это влияние передается, в основном, через систему ковалентных связей, с помощью так называемых электронных эффектов.
Электронными эффектами называют смещение электронной плотности в молекуле под влиянием заместителей.
Атомы, связанные полярной связью, несут частичные заряды, обозначаемые греческой буквой "дельта" (d). Атом, "оттягивающий" электронную плотность s-связи в свою сторону, приобретает отрицательный заряд d-. При рассмотрении пары атомов, связанных ковалентной связью, более электроотрицательный атом называют электроноакцептором. Его партнер по s-связи соответственно будет иметь равный по величине дефицит электронной плотности, т.е. частичный положительный заряд d+, будет называться электронодонором.
Смещение электронной плотности по цепи s-связей называется индуктивным эффектом и обозначается I.
Индуктивный эффект передается по цепи с затуханием. Направление смещения электронной плотности всех s -связей обозначается прямыми стрелками.
В зависимости от того, удаляется ли электронная плотность от рассматриваемого атома углерода или приближается к нему, индуктивный эффект называют отрицательным (-I) или положительным (+I). Знак и величина индуктивного эффекта определяются различиями в электроотрицательности между рассматриваемым атомом углерода и группой, его вызывающей.
Электроноакцепторные заместители, т.е. атом или группа атомов, смещающие электронную плотность s-связи от атома углерода к себе, проявляют отрицательный индуктивный эффект(-I-эффект).
Электродонорные заместители, т.е. атом или группа атомов, смещающие электронную плотность к атому углерода от себя, проявляют положительный индуктивный эффект (+I-эффект).
+I-эффект проявляют алифатические углеводородные радикалы, т.е. алкильные радикалы (метил, этил и т.д.). Большинство функциональных групп проявляют -I-эффект: галогены, аминогруппа, гидроксильная, карбонильная, карбоксильная группы.
Индуктивный эффект проявляется и в случае, когда связанные атомы углерода различны по состоянию гибридизации.
При передаче индуктивного эффекта метальной группы на двойную связь в первую очередь ее влияние испытывает подвижная p-связь.
Влияние заместителя на распределение электронной плотности, передаваемое по p-связям, называют мезомерным эффектом (М). Мезомерный эффект также может быть отрицательным и положительным. В структурных формулах его изображают изогнутой стрелкой, начинающейся у центра электронной плотности и завершающейся в том месте, куда смещается электронная плотность.
Наличие электронных эффектов ведет к перераспределению электронной плотности в молекуле и появлению частичных зарядов на отдельных атомах. Это определяет реакционную способность молекулы.
Индукти́вный эффе́кт (полярный эффект) — смещение электронной плотности химической связи по σ-связям. Является разновидностью эффекта поля.
Понятие об индуктивном эффекте было введено К. Ингольдом[1], им же были введены обозначения:
- +I-эффект в случае повышения заместителем электронной плотности;
- –I-эффект в случае понижения заместителем электронной плотности
В качестве вещества сравнения берут незамещённое соединение, то есть нулевой индуктивный эффект принимается для атома водорода.
Характерной особенностью индуктивного эффекта по сравнению с мезомерным эффектом является его быстрое затухание по цепочке связей.
Среди наиболее характерных +I-групп можно выделить: алкильные группы, металлы, металлоидные группы (силильные, борные, фосфорные и пр.); среди наиболее характерных групп с –I-эффектом выделяются заряженные группы (из-за эффекта поля), такие как триалкиламмониевые, диалкилсульфониевые и прочие ониевые соли, нитрогруппа, гидроксигруппа, алкоксигруппа, аминогруппа, галогены и т. п.
Фактически эффект обусловлен в первую очередь атомом, с которым непосредственно связан исходный атом углерода и определяется, таким образом, разницейэлектроотрицательностей атомов.
Количественная оценка индуктивного эффекта может быть произведена при помощи уравнения Тафта[
5 В простейшем случае сопряженные системы —
это системы с чередующимися двойными и одинарными связями. Они могут быть открытыми и закрытыми. Открытая система имеется в диеновых углеводородах (УВ).
Все атомы С находятся в состоянии sp-гибридиза-ции. Четыре негибридные р-орбитами, перекрываясь между собой, образуют единую электронную систему. Этот вид сопряжения называется p, p-сопряжением.
Происходит сопряжение р-электронов с S-электро-нами. Этот вид сопряжения называется р, р-сопряже-нием. Закрытая система имеется в ароматических УВ.
Сопряжение – процесс энергетически выгодный, энергия (Е) при этом выделяется. Энергия сопряжения бутадиена – 1,3 составляет 15 кДж/моль, энергия сопряжения бензола – 228 кДж/моль.
2. Ароматичность
Это понятие, включающее различные свойства ароматических соединений. Условия ароматичности:
1) плоский замкнутый цикл;
2) все атомы С находятся в sp2-гибридизации;
3) образуется единая сопряженная система всех атомов цикла;
4) выполняется правило Хюккеля: в сопряжении участвуют 4n + 2 р-электронов, где n = 1, 2, 3...
Простейший представитель ароматических углеводородов – бензол. Он соответствует всем четырем условиям ароматичности. Правило Хюккеля: 4n + 2 = 6, n = 1.
Нафталин – ароматическое соединение 4n + 2 = 10, n = 2.
Пиридин – ароматическое гетероциклическое соединение. Взаимное влияние атомов в молекуле
В 1861 г. русский ученый A. M. Бутлеров выдвинул положение: «Атомы в молекулах взаимно влияют друг на друга». В настоящее время это влияние передается двумя путями: индуктивным и мезомерным эффектами.
Индуктивный эффект – это передача электронного влияния по цепи р-связи. Известно, что связь между атомами с различной электроотрицательностью (ЭО) поляризована, смещена к более электроотрицательному атому. Это приводит к появлению на атомах эффективных (реальных) зарядов (d). Такое электронное смещение называется индуктивным и обозначается буквой «I» и стрелкой «?».
? +? –
СН3 – СН2? X, Х = Hal-, НО-, HS-, NH2– и др.
Индуктивный эффект может быть положительным или отрицательным. Если заместитель X притягивает электроны химической связи сильнее, чем атом Н, то он проявляет – I.I (H) = 0. В нашем примере X проявляет – I.
Если заместитель X притягивает электроны связи слабее, чем атом Н, то он проявляет +I. Все алкилы (R = СН3-, C2H 5 – и т. д.), Меп+ проявляют +I.
Мезомерный эффект (эффект сопряжения, резонансный эффект), вид взаимного влияния атомов в молекуле илиионе. заключающийся в статической поляризации сопряженной системы связей. Обусловлен смещением π-электронов сопряженных связей или неподеленных пар в сторону атомов с недостроенной до октета электронной оболочкой. Электронное смещение (обозначается изогнутой стрелкой) приводит к появлению частичных электрических зарядов на концах сопряженной цепи. Положительным мезомерным эффектом (+ М) обладают электронодонорные группы, способные к частичной или полной передаче пары электронов в общую сопряженную систему. Электроноакцепторные группы, поляризующие сопряженную систему в противоположном направлении, характеризуются отрицательным мезомерным эффектом (—М): + М-Эффект уменьшается:

при переходе от отрицательно заряженных заместителей к положительно заряженным, с возрастанием электроотрицательности атома, с увеличением номера периода в периодической системе. Увеличению — М-эффекта способствуют: наличие положительного заряда, более высокий номер группы и периода в периодической системе:

Важная особенность мезомерного эффекта - альтернирующий характер обусловливаемой им поляризации. Так, + М-эффект группы ОН приводит к увеличению электронной плотности в орто- и пара -положениях бензольного кольца (формула I), чем и объясняется электрофильное замещение только по этим положениям. Заместители с -М-эффектом понижают электронную плотность в орто- и пара -положениях бензольного кольца (II); этим объясняется электрофильная атака в мета-положения таких молекул.

Статический мезомерный эффект проявляется в значениях длин и силовых постоянных связей молекул, их дипольных моментов, констант равновесий (но не скоростей) реакций. Количественной мерой мезомерного эффекта групп, связанных с бензольным кольцом, служат sс (или sR)-константы заместителей, полученные вычитанием индукционных sI-констант из s-констант Гаммета. Мезомерный эффект поддается полуколичественной оценке при помощи теории возмущений.
Близок к мезомерному эффекту электромерный эффект (+ E, - E), заключающийся в поляризации сопряженной системы связей реагирующей молекулы или иона в переходном состоянии под влиянием электрических полей реагентов. В отличие от статического мезомерного эффекта этот эффект носит динамический характер. Его величина определяется поляризуемостью сопряженной системы, а направление поляризации всегда способствует понижению энергии переходного состояния. Поэтому, несмотря на сходство механизмов, возможны различные направления мезомерной и электромерной поляризации связей.
Гиперконъюгация — лишь один из видов сопряжения простых и кратных связей. Более широкие представления о сопряжении простой связи с двойной (σ,π-сопряжение) и двух простых связей (σ,σ-сопряжение) развиты А. Н. Несмеяновым, указавшим на ряд аналогий химического поведения π,π- σ,π- и σ,σ-сопряженных систем, например в реакциях 1,4-присоединения.
Простейшим примером молекулы, где связь Н—С сопряжена со связью С=С, может служить молекула пропилена. В этой молекуле благодаря влиянию метильной группы возникает электрическая асимметрия двойной связи

которая выражается, например, в дипольном моменте молекулы пропилена (0,35 D). Смещение π-электронной пары, очевидно, связано с некоторым смещением σ-электронов связей С—Н метильной группы в том же направлении. Обычно это изображают следующим образом:

В этом и заключается статический эффект сопряжения простых и двойных связей (σ,π-сопряжение).
6 Таутомерия — равновесная динамическая изомерия. Сущность её заключается во взаимном превращении изомеров с переносом какой-либо подвижной группы соответствующим перераспределением электронной плотности.
Кето-енольная таутомерия. Определенная протонная подвижность атома водорода у альфа-атома углерода в монокарбонильных соединениях (слабого СН-кислотного центра) проявляется в их способности к реакциям конденсации. Представим, что по каким-либо причинам подвижность такого атома водорода возросла настолько, что он оказался способным отщепиться в виде протона Н. Это должно привести к образованию мезомерного иона, отрицательный заряд которого рассредоточен между атомами углерода и кислорода. Обратное присоединение протона к этому иону в соответствии с его двумя граничными структурами может приводить либо к исходному карбонильному соединению, либо к енолу.
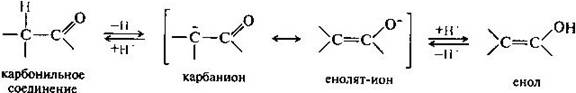
Поэтому, в принципе, карбонильное соединение в кетонной форме может существовать в равновесии с изомером — енольной формой. Такой вид изомерии называют кето-енольной таутомерией, а изомеры, находящиеся в состоянии подвижного равновесия, — таутомерами. В рассматриваемом случае между кетонной и енольной формами осуществляется перенос протона, поэтому такое равновесие называется прототропной таутомерией. В монокарбонильных соединениях (альдегидах, кетонах, сложных эфирах) равновесие практически полностью смещено в сторону кетонной формы. Например, содержание енольной формы в ацетоне составляет всего 0,00025%. При наличии второй электроноакцепторной группы у альфа-атома углерода (например, нитрогруппы —NО2, карбонильной группы =С=О) содержание енольной формы резко возрастает. Так, в 1,3-дикарбонильном соединении ацетилацетоне енольная форма преобладает.
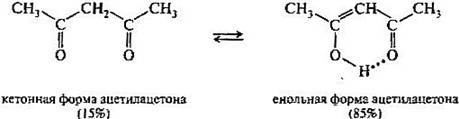
Многие реакции, включающие образование и превращения карбонильных соединен in vivo, как будет показано в дальнейшем, протекают через промежуточные енольные формы или производные этих форм.
Химическая сущность мутаротации состоит в способности моносахаридов (или моносахаридных звеньев в составе олиго- и полисахаридов) к существованию в виде равновесной смеси таутомеров — открытой и циклических форм. Такой вид таутомерии называется цикло-оксо-таутомерией (ранее еще называли кольчато-цепной). В растворах установление равновесия между четырьмя циклическими таутомерами моносахаридов протекает через открытую форму — оксоформу. Взаимопревращение альфа- и бета-аномеров друг в друга через промежуточную оксоформу называется аномеризацией. Таким образом, в растворе D-глюкоза существует в виде пяти таутомеров альфа- и бета-аномеров пиранозных и фуранозных циклических форм и оксоформы.

В смеси таутомеров преобладают пиранозные формы. Оксоформа, а также таутомеры с фуранозными циклами содержатся в малых количествах. Важно, однако, не абсолютное содержание того или иного таутомера, а возможность их перехода друг в друга, что приводит к пополнению количества нужной формы по мере ее расходования в каком-либо процессе. Например, несмотря на незначительное содержание оксоформы, глюкоза вступает в реакции, характерные для альдегидной группы. Это обусловлено сдвигом равновесия в сторону открытой формы по мере ее расходования в соответствующей реакции. Таутомерия лежит в основе множественности химических свойств моносахаридов.
? причины таутомерии
7 Гомологичный ряд
? номенклатура алканов
Получение алканов
9 Гомологический ряд алкенов. Получение алкенов.
|
|
Дата добавления: 2015-04-24; Просмотров: 1688; Нарушение авторских прав?; Мы поможем в написании вашей работы!