
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства
|
|
|
|
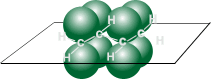
Атомы углерода в молекуле бутадиена-1,3 находятся в sp2 - гибридном состоянии, что означает расположение этих атомов в одной плоскости и наличие у каждого из них одной p- орбитали, занятой одним электроном и расположенной перпендикулярно к упомянутой плоскости.
 a) a)
|  b) b)
|
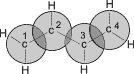
| Схематическое изображение строения молекул дидивинила (а) и вид модели сверху (b). Перекрывание электронных облаков между С1–С2 и С3–С4 больше, чем между С2–С3. |
p- Орбитали всех атомов углерода перекрываются друг с другом, т.е. не только между первым и вторым, третьим и четвертым атомами, но и также между вторым и третьим. Отсюда видно, что связь между вторым и третьим атомами углерода не является простой s- связью, а обладает некоторой плотностью p- электронов, т.е. слабым характером двойной связи. Это означает, что s- электроны не принадлежат строго определенным парам атомов углерода. В молекуле отсутствуют в классическом понимании одинарные и двойные связи, а наблюдается делокализация p- электронов, т.е. равномерное распределение p- электронной плотности по всей молекуле с образованием единого p- электронного облака.
Взаимодействие двух или нескольких соседних p- связей с образованием единого p- электронного облака, в результате чего происходит передача взаимовлияния атомов в этой системе, называется эффектом сопряжения.
Таким образом, молекула бутадиена -1,3 характеризуется системой сопряженных двойных связей.
Такая особенность в строении диеновых углеводородов делает их способными присоединять различные реагенты не только к соседним углеродным атомам (1,2- присоединение), но и к двум концам сопряженной системы (1,4- присоединение) с образованием двойной связи между вторым и третьим углеродными атомами. Отметим, что очень часто продукт 1,4- присоединения является основным.
Рассмотрим реакции галогенирования и гидрогалогенирования сопряженных диенов.
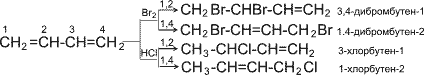
Как видно, реакции бромирования и гидрохлорирования приводят к продуктам 1,2- и 1,4- присоединения, причем количество последних зависит, в частности, от природы реагента и условий проведения реакции.
Важной особенностью сопряженных диеновых углеводородов является, кроме того, их способность вступать в реакцию полимеризации. Полимеризация, как и у олефинов, осуществляется под влиянием катализаторов или инициаторов.
Она может протекать по схемам 1,2- и 1,4- присоединения.
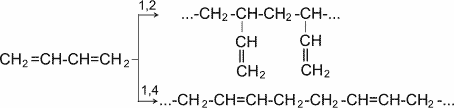
Полимеризация диеновых соединений
В упрощенном виде реакцию полимеризации бутадиена -1,3 по схеме 1,4 присоединения можно представить следующим образом:

| ––––® | 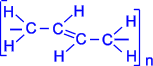 . .
|
В полимеризации участвуют обе двойные связи диена. В процессе реакции они разрываются, пары электронов, образующие s- связи разобщаются, после чего каждый неспаренный электрон участвует в образовании новых связей: электроны второго и третьего углеродных атомов в результате обобщения дают двойную связь, а электроны крайних в цепи углеродных атомов при обобщении с электронами соответствующих атомов другой молекулы мономера связывают мономеры в полимерную цепочку.
Элементная ячейка полибутадиена представляется следующим образом:
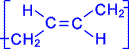 .
.
Как видно, образующийся полимер характеризуется транс - конфигурацией элементной ячейки полимера. Однако наиболее ценные в практическом отношении продукты получаются при стереорегулярной (иными словами, пространственно упорядоченной) полимеризации диеновых углеводородов по схеме 1,4- присоединения с образованием цис - конфигурации полимерной цепи. Например, цис- полибутадиен
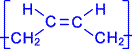 .
.
Натуральный и синтетический каучуки
Натуральный каучук получают из млечного сока (латекса) каучуконосного дерева гевеи, растущего в тропических лесах Бразилии.
При нагревании без доступа воздуха каучук распадается с образованием диенового углеводорода – 2- метилбутадиена-1,3 или изопрена. Каучук – это стереорегулярный полимер, в котором молекулы изопрена соединены друг с другом по схеме 1,4- присоединения с цис - конфигурацией полимерной цепи:

Молекулярная масса натурального каучука колеблется в пределах от 7 . 104 до 2,5 . 106.
транс - Полимер изопрена также встречается в природе в виде гуттаперчи.
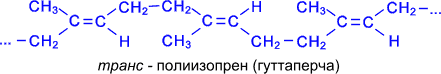
Натуральный каучук обладает уникальным комплексом свойств: высокой текучестью, устойчивостью к износу, клейкостью, водо- и газонепроницаемостью. Для придания каучуку необходимых физико-механических свойств: прочности, эластичности, стойкости к действию растворителей и агрессивных химических сред – каучук подвергают вулканизации нагреванием до 130-140°С с серой. В упрощенном виде процесс вулканизации каучука можно представить следующим образом:
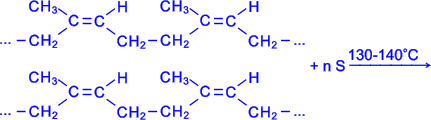
14 Свойства сопряженных диеновых углеводородов
7. Получение диеновых углеводородов CnH2n-2
| В промышленности |
| 1. Дегидрирование алканов: CH3-CH2-CH2-CH3 t,Cr2O3,Al2O3 → CH2=CH-CH=CH2 + 2H2 бутан бутадиен-1,3 (дивинил) CH3-CH-CH2-CH3 t,Cr2O3,Al2O3 → CH2=C-CH=CH2 + 2H2 │ │ СH3 CH3 2-метилбутан 2-метилбутадиен-1,3 (изопрен) |
| 2. Дегидрирование алкенов: CH2=CH-CH2-CH3 500-600,MgO,ZnO → CH2=CH-CH=CH2 + H2 бутен-1 бутадиен-1,3 |
3. Дегидратация и дегидрирование этанола: (р. Лебедева)
Каталитический способ получения бутадиена-1,3 из этанола был открыт в 1932 г. Сергеем Васильевичем Лебедевым. По способу Лебедева бутадиен-1,3 получается в результате одновременного дегидрирования и дегидратации этанола в присутствии катализаторов на основе ZnO и Al2O3:
2CH3-CH2-OH t=425,ZnO,Al2O3 → CH2=CH-CH=CH2 + H2 + 2H2O

|
8. Химические свойства диеновых углеводородов CnH2n-2
(характерны реакции горения, присоединения, обесцвечивают водный раствор перманганата калия и бромную воду)
| Реакции присоединения (+Г2; +НГ; +Н2; +НОН) |
| 1. Галогенирование: (образуется смесь продуктов) а) 1,2-присоединение CH2=CH-CH=CH2 + Br2 40°,ССl4-раствоитель → CH2-CH-CH=CH2 │ │ Br Br 3,4-дибромбутен-1 б) 1,4-присоединение (преимущественно) CH2=CH-CH=CH2 + Br2 -80°,гексан → CH2-CH=CH-CH2 │ │ Br Br 1,4-дибромбутен-2 в) Галогенирование достаточным количеством галогена: CH2=CH-CH=CH2 + 2Br2 → CH2-CH-CH-CH2 │ │ │ │ Br Br Br Br 1,2,3,4-тетрабромбутан |
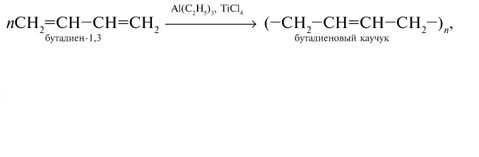
2. Полимеризация:
nCH2=CH-CH=CH2 t,Na → (-CH2-CH=CH-CH2-)n
синтетический – бутадиеновый каучук
Элементная ячейка полибутадиена представляется следующим образом:
 .
Как видно, образующийся полимер характеризуется транс- конфигурацией элементной ячейки полимера. Однако наиболее ценные в практическом отношении продукты получаются при стереорегулярной (иными словами, пространственно упорядоченной) полимеризации диеновых углеводородов по схеме 1,4- присоединения с образованием цис- конфигурации полимерной цепи. Например, цис- полибутадиен
.
Как видно, образующийся полимер характеризуется транс- конфигурацией элементной ячейки полимера. Однако наиболее ценные в практическом отношении продукты получаются при стереорегулярной (иными словами, пространственно упорядоченной) полимеризации диеновых углеводородов по схеме 1,4- присоединения с образованием цис- конфигурации полимерной цепи. Например, цис- полибутадиен
 .
nCH2=C-CH=CH2 t,Na → (-CH2-C=CH-CH2-)n
│ │
СH3 CH3
изопрен изопреновый каучук
.
nCH2=C-CH=CH2 t,Na → (-CH2-C=CH-CH2-)n
│ │
СH3 CH3
изопрен изопреновый каучук
|
16 Бутадиен получают по реакции Лебедева пропусканием этилового спирта через катализатор:
2CH3CH2OH → CH2=CH—CH=CH2 + 2H2O + H2
В нефтехимической промышленности основной способ получения бутадиена — дегидрогенизация бутана на алюмохромовых катализаторах:
CH3-CH2—CH2—CH3 → CH2=CH—CH=CH2 + 2Н2
Из интерента?
Полимеризация:
Хлоропрен (хлорбутадиен, 2-хлор-1,3-бутадиен), СН2=ССlСН=СН2
Получение: Начиная с 60-х годов 20-го века хлоропрен получают из ацетилена через винилацетилен.

Хлоропреновый каучук получают методом эмульсионной полимеризации хлоропрена.
Полимеризация хлоропрена протекает по радикальному механизму легче бутадиена и изопрена. При комнатной т-ре хлоропрен полимеризуется спонтанно с образованием каучукоподобного и губчатого полимеров:

|
Изопрен СН2=С(СН3)-СН=СН2, 2-метилбутадиен-1,3
Получение: Двухстадийным синтезом из изобутилена и формальдегида через 4,4-диметил-1,3-диоксан:
(CH3)2C=CH2 + 2 CH2O → (CH3)2(C4H6O2)
(CH3)2(C4H6O2) → CH2=C(CH3)-CH=CH2 + H2O + CH2O
Двухстадийным каталитическим дегидрированием изопентана (2-метилбутана) при 600 °С
CH3-CH(CH3)-CH2CH3 → CH2=C(CH3)-CH=CH2 + 2 H2
Изопрен в небольших количествах также выделяют из фракции С5, побочного продукта пиролиза нефти.
При полимеризации изопрена получают изопреновый каучук:
nСН2=С(СН3)-СН=СН2 → (-СН2-С(СН3)=СН-СН2-)n
17.?
18.
19 .
Ароматическими углеводородами (аренами) называются вещества, в молекулах которых содержится одно или несколько бензольных колец — циклических групп атомов углерода с особым характером связей.
Понятие “бензольное кольцо” требует расшифровки. Для этого необходимо рассмотреть строение молекулы бензола. Первая структура бензола была предложена в 1865г. немецким ученым А. Кекуле
: 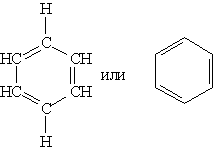 Эта формула правильно отражает равноценность шести атомов углерода, однако не объясняет ряд особых свойств бензола. Например, несмотря на ненасыщенность, бензол не проявляет склонности к реакциям присоединения: он не обесцвечивает бромную воду и раствор перманганата калия, т. е. не дает типичных для непредельных соединений качественных реакций.
Особенности строения и свойств бензола удалось полностью объяснить только после развития современной квантово-механической теории химических связей. По современным представлениям все шесть атомов углерода в молекуле бензола находятся в sp2-гибридном состоянии. Каждый атом углерода образует s -связи с двумя другими атомами углерода и одним атомом водорода, лежащие в одной плоскости. Валентные углы между тремя s -связями равны 120°. Таким образом, все шесть атомов углерода лежат в одной плоскости, образуя правильный шестиугольник (s -скелет молекулы бензола).
Каждый атом углерода имеет одну негибридизованную р-орбиталь. Шесть таких орбиталей располагаются перпендикулярно плоскому s -скелету и параллельно друг другу (см. рис. а). Все шесть электронов взаимодействуют между собой, образуя p -связи, не локализованные в пары как при образовании двойных связей, а объединенные в единое p -электронное облако. Таким образом, в молекуле бензола осуществляется круговое сопряжение.Наибольшая p -электронная плотность в этой сопряженной системе располагается над и под плоскостью s -скелета (см. рис. б).
Эта формула правильно отражает равноценность шести атомов углерода, однако не объясняет ряд особых свойств бензола. Например, несмотря на ненасыщенность, бензол не проявляет склонности к реакциям присоединения: он не обесцвечивает бромную воду и раствор перманганата калия, т. е. не дает типичных для непредельных соединений качественных реакций.
Особенности строения и свойств бензола удалось полностью объяснить только после развития современной квантово-механической теории химических связей. По современным представлениям все шесть атомов углерода в молекуле бензола находятся в sp2-гибридном состоянии. Каждый атом углерода образует s -связи с двумя другими атомами углерода и одним атомом водорода, лежащие в одной плоскости. Валентные углы между тремя s -связями равны 120°. Таким образом, все шесть атомов углерода лежат в одной плоскости, образуя правильный шестиугольник (s -скелет молекулы бензола).
Каждый атом углерода имеет одну негибридизованную р-орбиталь. Шесть таких орбиталей располагаются перпендикулярно плоскому s -скелету и параллельно друг другу (см. рис. а). Все шесть электронов взаимодействуют между собой, образуя p -связи, не локализованные в пары как при образовании двойных связей, а объединенные в единое p -электронное облако. Таким образом, в молекуле бензола осуществляется круговое сопряжение.Наибольшая p -электронная плотность в этой сопряженной системе располагается над и под плоскостью s -скелета (см. рис. б).
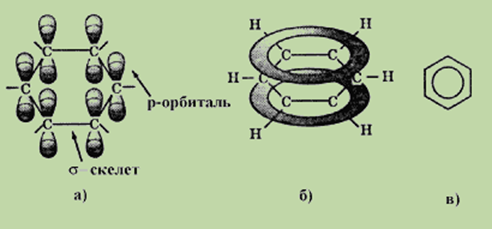 В результате все связи между атомами углерода в бензоле выровнены и имеют длину 0,139нм. Эта величина является промежуточной между длиной одинарной связи в алканах (0,154нм) и длиной двойной связи в алкенах (0,133 им). Равноценность связей принято изображать кружком внутри цикла (см. рис. в). Круговое сопряжение дает выигрыш в энергии 150 кДж/моль. Эта величина составляет энергию сопряжения — количество энергии, которое нужно затратить, чтобы нарушить ароматическую систему бензола.
Такое электронное строение объясняет все особенности бензола. В частности, понятно, почему бензол трудно вступает в реакции присоединения, — это привело бы к нарушению сопряжения. Такие реакции возможны только в очень жестких условиях.
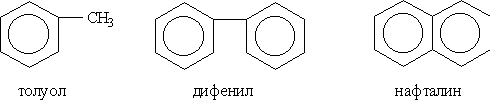
Номенклатура и изомерия. Условно арены можно разделить на два ряда. К первому относят производные бензола (например, толуол или дифенил), ко второму — конденсированные (полиядерные) арены (простейший из них — нафталин):
В результате все связи между атомами углерода в бензоле выровнены и имеют длину 0,139нм. Эта величина является промежуточной между длиной одинарной связи в алканах (0,154нм) и длиной двойной связи в алкенах (0,133 им). Равноценность связей принято изображать кружком внутри цикла (см. рис. в). Круговое сопряжение дает выигрыш в энергии 150 кДж/моль. Эта величина составляет энергию сопряжения — количество энергии, которое нужно затратить, чтобы нарушить ароматическую систему бензола.
Такое электронное строение объясняет все особенности бензола. В частности, понятно, почему бензол трудно вступает в реакции присоединения, — это привело бы к нарушению сопряжения. Такие реакции возможны только в очень жестких условиях.
Номенклатура и изомерия. Условно арены можно разделить на два ряда. К первому относят производные бензола (например, толуол или дифенил), ко второму — конденсированные (полиядерные) арены (простейший из них — нафталин):
 Гомологический ряд бензола отвечает общей формуле С6Н2n-6.
Гомологический ряд бензола отвечает общей формуле С6Н2n-6.
|
? правило Хюккеля
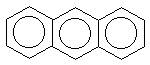
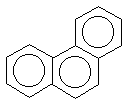
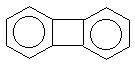
Правило Хюккеля об ароматичности (4n+2)  -электронной системы выведено для моноциклических систем. На полициклические конденсированные (т.е. содержащие несколько бензольных колец с общими вершинами) системы оно может быть перенесено для систем, имеющих атомы, общие для двух циклов, например, для показанных ниже нафталина, антрацена, фенантрена, бифенилена:(прим.12)
-электронной системы выведено для моноциклических систем. На полициклические конденсированные (т.е. содержащие несколько бензольных колец с общими вершинами) системы оно может быть перенесено для систем, имеющих атомы, общие для двух циклов, например, для показанных ниже нафталина, антрацена, фенантрена, бифенилена:(прим.12)

| 
| 
| 
|
| нафталин | фенантрен | антрацен | бифенилен |
Для соединений, имеющих хотя бы один атом, общий для трех циклов (например для пирена), правило Хюккеля неприменимо.
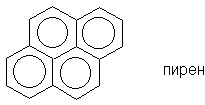
Ароматические гетероциклы представляют собой плоские циклические системы, содержащие вместо одного или нескольких атомов углерода атомы кислорода, серы, азота. Ароматическими их называют вследствие того, что они удовлетворяют всем критериям, присущим любой ароматической системе, а именно:
• система является циклической;
• цикл является плоским;
• имеется сопряжение по всему циклу, то есть возможность беспрепятственной делокализации любого из p-электронов по всей системе, благодаря наличию негибридизованных р-орбиталей;
• число делокализованных p-электронов, участвующих в сопряжении, отвечает, согласно правилу Хюккеля, проявлению ароматических свойств, а именно, равно 4n+2, где n – любое натуральное число, включая 0.
Среди ароматических гетероциклических соединений наиболее широко распространены и, соответственно, представляют наибольший интерес 5- и 6-членные гетероциклы, имеющие в своем составе азот, серу и кислород, а также эти же системы, конденсированные с бензольным кольцом.
К пятичленным циклическим системам с одним гетероатомом относятся пиррол, фуран и тиофен:

Из пятичленных гетероциклов с двумя гетероатомами наибольший практический интерес представляет имидазол.
20??? Гомологический ряд ароматических соединений, Номенклатура
Получение: Способы получения аренов
1.
Ароматизация парафинов (алканов):
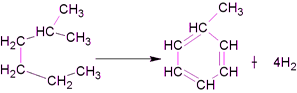
2-метилгексан толуол
2.
Реакция Бертло:
3СН ≡СН t акт. уголь >С6Н6
Этин бензол
3.
Дегидрирование циклоалканов (метод Зелинского):
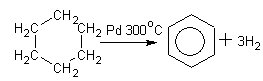
Циклогексан бензол
4.
Реакция Вюрца – Фиттига (подобна алканам):
С6Н5Вr + 2Na + CH3Br → С6Н5 CH3 + 2 NaBr
бромбензол бромметан толуол
Целевой продукт реакции: С6Н5 CH3
Побочные продукты: С6Н5 - С6Н5 (дифенил) и CH3 - CH3 (этан).
В отличие от подобной реакции у алканов целевой и побочные продукты реакции можно легко разделить.
5.
Реакция Фриделя-Крафтса –Густавсона (каализатор реакции AlCl3)
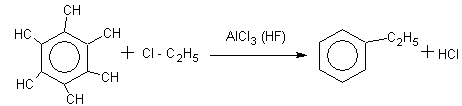
Бензол хлорэтан этилбензол
Реакция имеет большое промышленное значение для получения изопропилбензола:
С6Н6 + CH3–CH2–CH2Cl AlCl3 > HCl + C6H5CH2CH2CH3 пропилбензол
бензол хлорпропан -->C6H5CH(CH3)2 изопропил бензол
Вместо галогенопроизводных можно использовать спирты. В этом случае катализаторами служат H2SO4, HF, H3PO4.
6. Синтез из солей ароматических карбоновых кислот (при нагревании):
C6H5-COONa +NaOH t __>C6H6 + Na2CO3
21???
22 Химические свойства
Химическое поведение галогенуглеводородов определяется такими факторами как энергия связи С–Hal, полярность этой связи и ее поляризуемость. Так, относительная слабость связей С–Cl, C–Br и СJ обусловливает их предпочтительное гомолитическое расщепление по сравнению со связями С–С и С–Н. В то же время полярность связей С–Hal и их более высокая поляризуемость по сравнению со связями С–С и С–Н является предпосылкой для их гетеролитического расщепления. Приводимые ниже реакции являются иллюстрацией этих положений.
1. Замещение галогена на водород.
Восстановление галогенпроизводных до углеводородов осуществляется водородом в присутствии обычных катализаторов гидрирования (Ni, Pt, Pd):
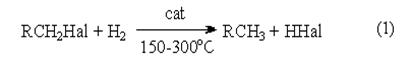
Реакция имеет гомолитический характер, связанный с предварительной сорбцией реагентов на поверхности катализатора, причем водород претерпевает диссоциативную адсорбцию с вовлечением адсорбированных атомов водорода в реакцию восстановления

где S – поверхность катализатора.
Реакция (1) имеет важное практическое значение как метод переработки галогенорганических отходов в промышленном органическом синтезе. В отличие от другого метода обезвреживания галогенорганических отходов, сжигания, этот метод является ресурсосберегающим и экологически безопасным, так как при его реализации регенерируется углеводородная составляющая исходного сырья и исключается образование высокотоксичных полихлордибензодиоксинов и полихлордибензофуранов.
Другой метод замещения галогена на водород – взаимодействие галогенпроизводных углеводородов с иодоводородной кислотой при нагревании

Метод имеет препаративное значение.
2. Взаимодействие с металлами.
а) реакция димеризации (синтез Вюрца)
2RHal + Na ® R–R + 2NaHal
Механизм этой реакции может быть представлен следующей последовательностью стадий:

Такой характер взаимодействия является выражением природы реагентов. Натрий как очень активный металл легко отдает свой электрон молекуле галогенуглеводорода, которая выступает в роли слабого электрофила. Электрофильные свойства молекулы R–Hal вытекают из полярности связи С–Hal, обусловливающей дефицит электронов на атоме углерода. Образующийся интермедиат распадается на алкильный радикал и натриевую соль галогена, причем прочная ионная связь в последней обусловливает легкость этого распада. Аналогично можно объяснить энергетическую выгодность последующих реакций механизма.
Реакция имеет препаративное значение.
б) Взаимодействие с магнием (реакция Гриньяра).
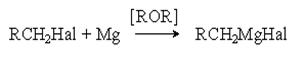
Механизм этой реакции в части ее инициирования подобен механизму реакции Вюрца

Реактивы Гриньяра имеют важнейшее значение в препаративной органической химии, поскольку открывают возможности получения широкого разнообразия органических соединений на основе взаимодействия этих реактивов с различными реагентами.
3. Реакции нуклеофильного замещения
Реакции нуклеофильного замещения – наиболее типичный круг реакций, в которых галогенуглеводороды выступают в качестве субстратов. Результатом этих реакций является замещение галогена на другой атом или группу, которые либо непосредственно выступают в роли нуклеофильного реагента, либо входят в его состав в качестве фрагмента.
Наиболее типичными реакциями нуклеофильного замещения галогеналканов и других галогенпроизводных являются:
а) реакции гидролиза
RHal + H2O ® ROH + HHal
RHal + NaOH ® ROH + NaHal
б) реакции образования простых эфиров (реакция Вильямсона)
RHal + R`ONa ® ROR` + NaHal
в) синтез сложных эфиров
R1Hal + RCOONa ® RCOOR1 + NaHal
г) аммонолиз
RHal + 2NH3 ® RNH2 + NH4Hal
д) синтез нитросоединений и нитритов

е) синтез нитрилов и изонитрилов
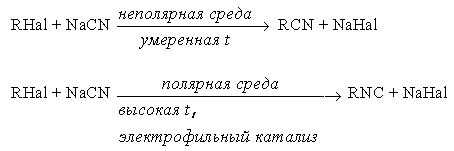
ж) синтез тиолов и сульфидов
R–Hal + NaSH ® RSH + NaHal
R–Hal + R1SNa ® RSR1 + NaHal
2R–Hal + Na2S ® RSR + 2NaHal
з) синтез фосфорорганических соединений
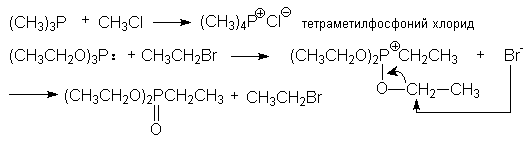
(CH3)2PH + CH3CH2Br + NaOH ® (CH3)2PCH2CH3 + NaBr + H2O
диметилэтилфосфин
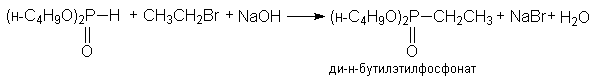
и) синтез углеводородов на основе Mg-органических соединений
R–MgHal + R’Hal ® R–R’ + MgHal2
к) замещение галогена на галоген
RX + NaY ® RY + NaY
(см. подробно методы получения галогеналканов)
Из приведенных реакций можно видеть, что реакции нуклеофильного замещения могут служить методом образования связей С–С, С–О, С–S, C–N, C–P и C–Hal.
23????
24 Реакции SN1
Механизм реакции SN1 или реакции мономолекулярного нуклеофильного замещения ( substitution nucleophilic unimolecular ) включает следующие стадии:
1. Ионизация субстрата с образованием карбкатиона (медленная стадия):
R−X → R+ + X−
2. Нуклеофильная атака карбкатиона (быстрая стадия):
R+ + Y− → R−Y
или (если в качестве нуклеофила выступает нейтральная частица):
R+ + Y−Z → R−Y+−Z
3. Отщепление катиона (быстрая стадия):
R−Y+−Z → R−Y + Z+
Примером реакции SN1 является гидролиз трет-бутилбромида:
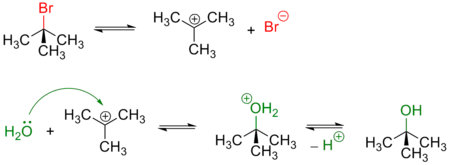
Условный энергетический профиль реакции мономолекулярного нуклеофильного замещения представлен на диаграмме.


Условный энергетический профиль реакции SN1
Скорость реакции SN1 (в упрощённом виде) не зависит от концентрации нуклеофила и прямо пропорциональна концентрации субстрата:
Скорость реакции = k × [RX]
Так как в процессе реакции образуется карбкатион, его атака (в идеальных условиях без учёта фактора влияния заместителей) нуклеофилом может происходить с обеих сторон, что приводит к рацемизации образующегося продукта.
Важно иметь в виду, что SN1 механизм реализуется только в случае относительной устойчивости промежуточного карбкатиона, поэтому по такому пути, обычно, реагируют только третичные ((R)3C-X) и вторичные ((R)2CH-X) алкилпроизводные.
Реакции SN2


Условный энергетический профиль реакции SN2
Механизм реакции SN2 или реакции бимолекулярного нуклеофильного замещения ( substitution nucleophilic bimolecular ) происходит в одну стадию, без промежуточного образования интермедиата. При этом атака нуклеофила и отщепление уходящей группы происходит одновременно:
R−X + Y− → [Y⋯R⋯X]− → R−Y + X−
Примером реакции SN2 является гидролиз этилбромида:
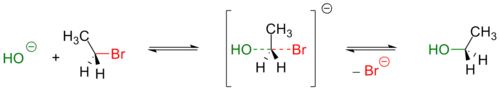
Условный энергетический профиль реакции бимолекулярного нуклеофильного замещения представлен на диаграмме.
Скорость реакции SN2 зависит как от концентрации нуклеофила, так и концентрации субстрата:
Скорость реакции = k × [RX] × [Y]
Так как в процессе реакции атака нуклеофилом может происходить только с одной стороны, результатом реакции является стереохимическая инверсия образующегося продукта.
Ещё в 1895 году году этот эффект обнаружил латышский химик Пауль Вальден («обращение Вальдена»), однако он не смог его объяснить[5]. В 1935 году Хьюз исследуя реакцию оптически активного 2-йодоктана с йодид-ионом обнаружил, что реакция имеет общий второй кинетический порядок и первый по каждому из реагентов, а также что скорость рацемизации в два раза выше скорости внедрения йода в молекулу йодоктана[2]. Так было сформулировано стереохимическое SN2 правило:
В реакциях бимолекулярного нуклеофильного замещения атакующий нуклеофил стереохимически инвертирует молекулу, в которой он замещает уходящую группу .
25 Химические свойства
1. Благодаря наличию электронной пары на атоме азота, все амины обладают основными свойствами, причем алифатические амины являются более сильными основаниями, чем аммиак.
Водные растворы аминов имеют щелочную реакцию:
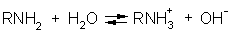
Константы основности аммиака и низших аминов: X + Н2О 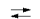 ХH+ + ОН-
ХH+ + ОН-
| Формула | Название | Kb |
| NH3 CH3NH2 (CH3)2NH (CH3)3N | Аммиак Метиламин Диметиламин Триметиламин | 1,8.10-5 4,4.10-4 5,4.10-4 6,5.10-5 |
Амины в чистом виде или в растворах взаимодействуют с кислотами, образуя соли, которые являются аналогами солей аммония:
CH3NH2 + H2SO4 → [CH3NH3]HSO4,
C6H5NH2 + HCl → [C6H5NH3]Cl.
Соли аминов — твердые вещества, хорошо растворимые в воде и плохо растворимые в неполярных органических растворителях. Щелочи превращают соли аминов в свободные амины подобно тому, как из солей аммония щелочи вытесняют аммиак.
[CH3NH3]Cl + NaOH  CH3NH2↑ + NaCl + Н2О.
CH3NH2↑ + NaCl + Н2О.
2. Амины — органические аналоги аммиака, поэтому они могут образовывать комплексные соединения с переходными металлами:
Сu2+ + 4CH3NH2 = [Cu(NH2CH3)4]2+.
Неподеленная пара электронов амина в этих комплексах занимает свободную орбиталь во внешнем слое центрального атома, образуя донорно-акцепторную связь.
3. Первичные и вторичные амины реагируют с азотистой кислотой, образующейся при добавлении нитрита натрия к разбавленной соляной кислоте:
NaNO2 + HCl → HNO2 + NaCl.
Первичные амины под действием азотистой кислоты превращаются в спирты:
RNH2 + HNO2 → ROH + N2↑ + H2O.
Промежуточным соединением в этой реакции является неустойчивый ион диазония [R-N≡N]+.
Вторичные амины с азотистой кислотой дают N-нитрозамины — маслянистые жидкости с характерным запахом:
R2NH + HO-N=O → R2N-N=O + Н2О.
Третичные алифатические амины с азотистой кислотой не реагируют. Таким образом, азотистая кислота — реагент, позволяющий определять тип амина.
4. При сгорании аминов образуются углекислый газ, азот и вода:
4CnH2n+3N + (6n+3)O2 = 2N2 + 4nCO2 + (4n+6)Н2О
Применение. Низшие алифатические амины используются для синтеза лекарственных средств, пестицидов и пластмасс.
Читайте далее:
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 2718; Нарушение авторских прав?; Мы поможем в написании вашей работы!