
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Вывод основного уравнения МКТ. Физический смысл термодинамической температуры. Среднеквадратичная скорость. Средняя энергия поступательного движения молекул газа
|
|
|
|
Атомно-молекулярное строение вещества. Термодинамический и молекулярно-кинетический подходы к изучению вещества. Равновесное состояние. Термодинамичесике параметры. Модель идеального газа. Уравнение состояния идеального газа.
Для большинства веществ частицы представляют собой молекулы. Молекула — наименьшая частица вещества, обладающая его химическими свойствами. Молекулы в свою очередь состоят из атомов. Атом — наименьшая частица элемента, обладающая его химическими свойствами.
Термодинамика изучает свойства макроскопических систем и протекающие в них процессы, не вдаваясь в микроскопическую природу тел.
Основные положения молекулярно-кинетической теории заключаются в следующем:
все тела в природе состоят из мельчайших частиц (атомов и молекул). Наши органы чувств воспринимают их как сплошные или непрерывные;
эти частицы находятся в непрерывном хаотическом движении;
между частицами вещества существуют силы притяжения и отталкивания, зависящие от расстояния между частицами.
Термодинамическая система может находиться в различных состояниях, отличающихся температурой, давлением, объемом, плотностью и т.д. Подобные величины, характеризующие состояние системы, называются параметрами состояния.
Состояние термодинамической системы будет равновесным, если все параметры состояния имеют равные значения для любых областей системы, не изменяющиеся с течением времени, т.е. сохраняющиеся бесконечно долго при неизменных внешних воздействиях.
Сначала рассмотрим самую простую модель термодинамической системы – идеальный газ. В модель идеального газа заложено два основных предположения: первое – о невзаимодействии молекул газа на расстоянии (взаимодействие осуществляется только в пренебрежимо краткое по сравнению со временем полета время соприкосновения), и второе – о возможности пренебрежения собственным объемом молекул по сравнению с полным объемом, занимаемым газом. Эта модель хорошо себя оправдывает в случае достаточно разреженных газов, когда диаметр молекул много меньше среднего расстояния между ними. Разумеется, применимость модели идеального газа не безгранична, и имеется достаточно много явлений (например, фазовые превращения – переход из одного агрегатного состояния в другое), для анализа которых даже на качественном уровне модель идеального газа непригодна и, значит, в этих случаях следует обращаться к более сложным моделям. Уравнение состояния идеального газа в расчете на один моль принимает вид
РV = RT
Пусть имеется кубический сосуд с ребром длиной  и одна частица массой
и одна частица массой  в нём.
в нём.
Обозначим скорость движения  , тогда перед столкновением со стенкой сосуда импульс частицы равен
, тогда перед столкновением со стенкой сосуда импульс частицы равен  , а после —
, а после — 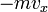 , поэтому стенке передается импульс
, поэтому стенке передается импульс  . Время, через которое частица сталкивается с одной и той же стенкой, равно
. Время, через которое частица сталкивается с одной и той же стенкой, равно  .
.
Отсюда следует:

Так как давление  , следовательно сила
, следовательно сила 
Подставив, получим: 
Преобразовав: 
Так как рассматривается кубический сосуд, то 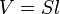
Отсюда:
 .
.
Соответственно,  и
и  .
.
Таким образом, для большого числа частиц верно следующее:  , аналогично для осей y и z.
, аналогично для осей y и z.
Поскольку  , то
, то  . Это следует из того, что все направления движения молекул в хаотичной среде равновероятны.
. Это следует из того, что все направления движения молекул в хаотичной среде равновероятны.
Отсюда 
или  .
.
Пусть  — среднее значение кинетической энергии всех молекул, тогда:
— среднее значение кинетической энергии всех молекул, тогда:
 , откуда, используя то, что
, откуда, используя то, что 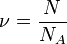 (количество вещества), а
(количество вещества), а  , имеем
, имеем  .
.
Абсолютная термодинамическая температура — Хаотическое тепловое движение на плоскости частиц газа таких как атомы и молекулы.
Уравнение среднеквадратичной скорости молекулы
Уравнение среднеквадратичной скорости молекулы легко выводится из основного уравнения МКТ для одного моля газа.
 ,
,
 , где
, где 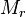 — молярная масса газа
— молярная масса газа
Отсюда окончательно

|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 1601; Нарушение авторских прав?; Мы поможем в написании вашей работы!