
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Барометрическая формула. Распределение Больцмана
|
|
|
|
Вероятность случайного события и распределение скоростей молекул. Функции распределения Максвелла по скоростям. Графики функции распределения Максвелла по скоростям, их поведение в зависимости от температуры и массы молекул идеального газа.
При выводе основного уравнения молекулярно-кинетической теории молекулам задавали различные скорости. В результате многократных соударений скорость каждой молекулы изменяется по модулю и направлению. Однако из-за хаотического движения молекул все направления движения являются равновероятными, т. е. в любом направлении в среднем движется одинаковое число молекул.
По молекулярно-кинетической теории, как бы ни изменялись скорости молекул при столкновениях, средняя квадратичная скорость молекул массой т0 в газе, находящемся в состоянии равновесия при Т= const. остается постоянной и равной 
Это объясняется тем, что в газе, находящемся в состоянии равновесия, устанавливается некоторое стационарное, не меняющееся со временем распределение молекул по скоростям, которое подчиняется вполне определенному статистическому закону. Этот закон теоретически выведен Дж. Максвеллом.
При выводе закона распределения молекул по скоростям Максвелл предполагал, что газ состоит из очень большого числа N тождественных молекул, находящихся в состоянии беспорядочного теплового движения при одинаковой температуре. Предполагалось также, что силовые поля на газ не действуют.
Закон Максвелла описывается некоторой функцией f(v), называемой функцией распределения молекул по скоростям. Если разбить диапазон скоростей молекул на малые интервалы, равные dv, то на каждый интервал скорости будет приходиться некоторое число молекул dN(v), имеющих скорость, заключенную в этом интервале. Функция f(v) определяет относительное число молекул dN(v)/N, скорости которых лежат в интервале от v до v+dv, т. е.
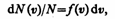 откуда
откуда 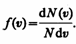
Применяя методы теории вероятностей. Максвелл нашел функцию f(v) — закон о распределения молекул идеального газа по скоростям:
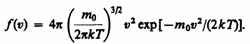 (1)
(1)
Из (1) видно, что конкретный вид функции зависит от рода газа (от массы молекулы) и от параметра состояния (от температуры Т).
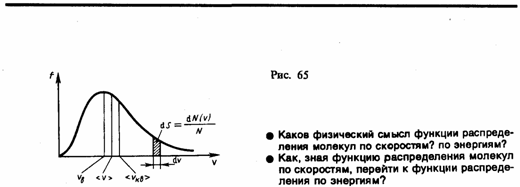
График функции (1) приведен на рис. 65. Так как при возрастании v множитель exp[–m0v2/(2kT)] уменьшается быстрее, чем растет множитель v2, то функция f(v), начинаясь от нуля, достигает максимума при vB, и затем асимптотически стремится к нулю. Кривая несимметрична относительно vB.
Относительное число молекул dN(v)/N, скорости которых лежат в интервале от v до v+dv, находится как площадь заштрихованной полоски на рис. 65. Площадь, ограниченная кривой распределения и осью абсцисс, равна единице. Это означает, что функция f(v) удовлетворяет условию нормировки 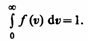
Скорость, при которой функция распределения молекул идеального газа по скоростям максимальна, называется наиболее вероятной скоростью. Значение наиболее вероятной скорости можно найти продифференцировав выражение (1) (постоянные множители опускаем) по аргументу v, приравняв результат нулю и используя условие для максимума выражения f(v):

Значения v=0 и v=¥ соответствуют минимумам выражения (1), а значение v, при котором выражение в скобках становится равным нулю, и есть искомая наиболее вероятная скорость vB:
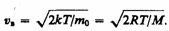 (2)
(2)
Из формулы (2) следует, что при повышении температуры максимум функции распределения молекул по скоростям (рис. 66) сместится вправо (значение наиболее вероятной скорости становится больше). Однако площадь, ограниченная кривой, остается неизменной, поэтому при повышении температуры кривая распределения молекул по скоростям будет растягиваться и понижаться.
Средняя скорость молекулы <v> (средняя арифметическая скорость) определяется по формуле

Подставляя сюда f(v) и интегрируя, получаем 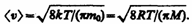 (3)
(3)
Скорости, характеризующие состояние газа: 1) наиболее вероятная 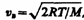 2) средняя
2) средняя  3) средняя квадратичная
3) средняя квадратичная  (рис. 65). Исходя из распределения молекул по скоростям
(рис. 65). Исходя из распределения молекул по скоростям
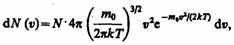 (4)
(4)
можно найти распределение молекул газа по значениям кинетической энергии e. Для этого перейдем от переменной v к переменной e=m0v2/2. Подставив в (4), получим

где dN(e) — число молекул, имеющих кинетическую энергию поступательного движения, заключенную в интервале от e до e + de.
Таким образом, функция распределения молекул по энергиям теплового движения

Средняя кинетическая энергия <e> молекулы идеального газа


35. Скорости движения молекул: наиболее вероятная, среднеарифметическая, среднеквадратичная, их определения с помощью функции распределения Максвелла.
Наиболее вероятная, среднеквадратичная и средняя арифметическая скорости молекул газа
Рассмотрим, как изменяется с абсолютной величиной скорости число частиц, приходящихся на единичный интервал скоростей, при единичной концентрации частиц.
График функции распределения Максвелла
 , ,
|
приведен на рисунке 2.6.

Рис. 2.6
Из графика видно, что при «малых» υ, т.е. при  , имеем
, имеем  ; затем
; затем 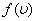 достигает максимума А и далее экспоненциально спадает
достигает максимума А и далее экспоненциально спадает  .
.
Величину скорости, на которую приходится максимум зависимости 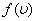 , называют наиболее вероятной скоростью.
, называют наиболее вероятной скоростью.
Найдем эту скорость из условия равенства производной  .
.
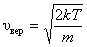 , ,
| (2.3.6) |
– наиболее вероятная скорость одной молекулы.
Для одного моля газа:
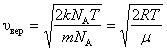 . .
| (2.3.7) |
Среднюю квадратичную скорость найдем, используя соотношение 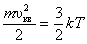 :
:
 . .
| – для одной молекулы; | (2.3.8) |
 . .
| – для одного моля газа. | (2.3.9) |
Средняя арифметическая скорость:
 . .
| . |
где  – число молекул со скоростью от υ до υ+dυ. Если подставить сюда f (υ) и вычислить, то получим:
– число молекул со скоростью от υ до υ+dυ. Если подставить сюда f (υ) и вычислить, то получим:
 . .
| – для одной молекулы; | (2.3.10) |
 . .
| – для одного моля газа. | (2.3.11) |
Все три скорости незначительно отличаются друг от друга множителем порядка единицы, причем 
Барометрическая формула (Б.ф.) определяет зависимость давления или плотности газа от высоты в поле тяжести.
Для идеального газа, имеющего постоянную температуру Т и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения g одинаково), Б. ф. имеет следующий вид: р = p0exp [-gm.(h - h0)/RT] (1),
где р — давление газа в слое, расположенном на высоте h, p0 — давление на нулевом уровне (h = h0), m — молекулярная масса газа, R — газовая постоянная, Т — абсолютная температура. Графически зависимость (1) представлена на рис. Из Б. ф. (1) следует, что концентрация молекул n (или плотность газа) убывает с высотой по тому же закону:
n =n0exp [-mg (h-h0)/kT],
где m — масса молекулы, k — Больцмана постоянная.
Б. ф. может быть получена из закона распределения молекул идеального газа по скоростям и координатам в потенциальном силовом поле (см. Больцмана статистика). При этом должны выполняться два условия: постоянство температуры газа и однородность силового поля. Аналогичные условия могут выполняться и для мельчайших твёрдых частичек, взвешенных в жидкости или газе. Основываясь на этом, французский физик Ж. Перрен в 1908 применил Б. ф. к распределению по высоте частичек эмульсии, что позволило ему непосредственно определить значение постоянной Больцмана.
Б. ф. показывает, что плотность газа уменьшается с высотой по экспоненциальному закону. Величина —mg (h-h0)/kT, определяющая быстроту спада плотности, представляет собой отношение потенциальной энергии частиц к их средней кинетической энергии, пропорциональной kT. Чем выше температура Т, тем медленнее убывает плотность с высотой. С другой стороны, возрастание силы тяжести mg (при неизменной температуре) приводит к значительно большему уплотнению нижних слоев и увеличению перепада (градиента) плотности. Действующая на частицы сила тяжести mg может изменяться за счёт двух величин: ускорения g и массы частиц m.
Следовательно, в смеси газов, находящейся в поле тяжести, молекулы различной массы по-разному распределяются по высоте.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 2171; Нарушение авторских прав?; Мы поможем в написании вашей работы!