
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Следствия из основного ур-ия МКТ
|
|
|
|
Уравнение Клаузиуса - основное ур-е мкт идеального газа.
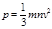 -давление газа на стенку.
-давление газа на стенку.
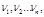 Если газ состоит из N молекул, движущихся со скоростями
Если газ состоит из N молекул, движущихся со скоростями
-то вводится понятие средней квадратичной
скорости:
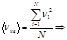
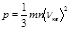
Уравнение Клаузиуса связывает
характеристики макромира 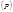 с
с
Характеристиками микромира 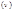
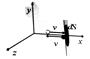 Вывод уравнения Клаузиуса
Вывод уравнения Клаузиуса
Удар о стенку – абсолютно упругий.
За счет действия силы реакции опоры импульс меняется на противоположный:
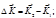
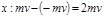 -изменение импульса молекулы
-изменение импульса молекулы
при ударе об стенку
1.Внутренняя энергия идеального газа.
В сосуде N молекул, каждая обладает энергией 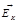

Внутренняя энергия: 
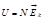 .
.
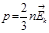
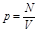
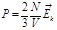
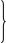 2.Абсолютная температура – мера интенсивности хаотического движения атомов и молекул.
2.Абсолютная температура – мера интенсивности хаотического движения атомов и молекул.
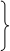
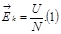
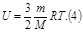
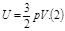
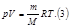
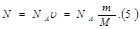
подставляем в (1)
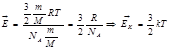
Абсолютная температура – мера энергии хаотического движения (мера интенсивности хаотического движения).
3.Другой вид уравнения.
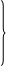
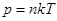

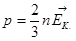

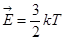
64. Макроскопические тела. Статистический и термодинамический метод.
*статистический метод:
В основе лежит модель, которая описывается уравнениями теории вероятности и математической статистики.
Основываясь на молекулярно-кинетических представлениях о веществе (все тела состоят из молекул, находящихся в непрерывном хаотическом движении), сформулированы статические распределения
Статистические распределения:
1распределение молекул по объему- n=const
2 распределение молекул по скоростям–распределение максвелла
3 распределение молекул по потенциальным энергиям – распределение Больцмана
4.закон равномерного распределения энергии по степеням свободы.
Из этих распределений получают средние значения физических величин, которые характеризуют состояние системы.
*термодинамический метод:
В основе лежат опытные факты, проверенные человеком.
Достоверность этого метода выше.
Метод изучает общие свойства макроскопических систем, находящиеся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями.
Основные законы термодинамики:
1 начало термодинамики - закон сохранения энергии тепловых процессов. 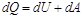 ,
,
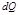 -тепло, подводимое к системе,
-тепло, подводимое к системе,
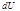 -внутренняя энергия системы
-внутренняя энергия системы
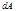 -работа,совершаемая системой
-работа,совершаемая системой
2 начало термодинамики - характеризует направление протекания процессов. дополняет 1 начало термодинамики.
Формулировка Клаузиуса (1850г):тепло не может самопроизвольно переходить от тепла, менее нагретого, к более нагретому.
Для кругового процесса: 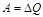
3 начало термодинамики: абсолютный нуль температуры недостижим- теорема Нернста.
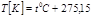
Абсолютный нуль температуры, при которой прекращается хаотическое движение молекул.
65. Термодинамическая система - совокупность макроскопических тел, которые обмениваются энергией, как между собой, так и с внешним телами(внешней средой).
Одно макроскопическое тело это уже термодинамическая система.
Статический и термодинамический метод(смотреть в 1ом билете)
Равновесные процессы –процесс при которых скоростью изменения термодинамических параметров бесконечно мала, т.е. изменение термод-их параметров происходит за бесконечно большие времена.
 Равновесные процессы –процесс, который проходит через последовательность равновесных сотояний.
Равновесные процессы –процесс, который проходит через последовательность равновесных сотояний.
Любое равновесное состояние
может быть изображено точкой.
Следовательно, любой равновес процесс можно изобразить
графически.
Неравновесный процесс – процесс, при которомизменение термодинамических параметров на конечную величину происходит за конечное время.
66. Идеальный газ – модель.
1.Собственны объем молекул газа пренебрежимо мал по сравнению с объемом пренебрежимо мал по сравнению с объемом сосуда. à Молекула – материальная точка.
2. Между молекулами газа отсутствуют силы взаимодействия.
3.Столкновения молекул газа между собой и со стенками сосуда абсолютно упругие. Следовательно идеальный газ – система независимых материальных точек.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 742; Нарушение авторских прав?; Мы поможем в написании вашей работы!