
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Степени свободы. Закон равномерного распределение энергии по степеням свободы
|
|
|
|
Опыт Перенна.

m-масса шарика; mж- масса объёма жидкости, вытесненной шариком.
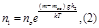
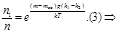
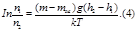
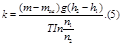
Опыт Перена. Определение число Авогадро.
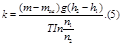
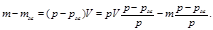
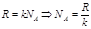
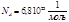
Получим
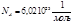
Точное значения
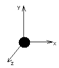 Степени свободы- число независимых координат, определяющих положение и конфигурацию системы в пространстве.
Степени свободы- число независимых координат, определяющих положение и конфигурацию системы в пространстве.
1.Одноатомный газ имеет три степени свободы,
 т.к. может двигаться в 3-х направлениях. Следовательно, обладает 3 поступательными степенями свободы.
т.к. может двигаться в 3-х направлениях. Следовательно, обладает 3 поступательными степенями свободы.
Молекула- материальная точка.
Энергия вращательного движения нет
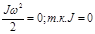
2.Двухатомная жестко связанная молекула (совокупность двух точек, связанных недеформируемой связью)
обладает 3 поступательными и 2 вращательными степенями свободы. Вращение относительно оси 33’ не меняет положение молекулы в пространстве.
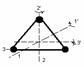 3. Трех атомная жестко связанная молекула.
3. Трех атомная жестко связанная молекула.
обладает 3 поступательными и 3 вращательными степенями свободы.
Закон равномерного распределение энергии по степеням свободы.
 если система частиц находится в состоянии термодинамического равновесия, то средняя кинетическая энергия хаотического движения молекул, приходится на 1 степень свободы поступательного и вращательного движения равна
если система частиц находится в состоянии термодинамического равновесия, то средняя кинетическая энергия хаотического движения молекул, приходится на 1 степень свободы поступательного и вращательного движения равна
Для реальных молекул, не обладающих жёсткими
связями между молекулами, необходимо учитывать также степени свободы колебательного движения.
На колебательную степень свободы приходится не только кинетическая энергия, но и потенциальная, причём среднее значение кинетической энергии равно среднему значению и
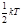
равно, Следовательно, средняя суммарная энергия
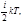
молекулы

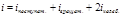
В идеальном газе взаимная потенциальная энергия молекул
т.к. молекулы между собой не взаимодействуют, то рассматривается только кинетическая энергия, и
1. для 1 моля газа внутренняя энергия равна сумме кинетических энергий NA молекул:
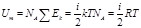
Для произвольной массы m газа:
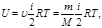 -количество вещества.
-количество вещества.
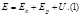 75. Внутренняя энергия системы - функция состояния. Макроскопическая работа. Теплота. Эквивалентность теплоты и работы. Первое начало термодинамики.
75. Внутренняя энергия системы - функция состояния. Макроскопическая работа. Теплота. Эквивалентность теплоты и работы. Первое начало термодинамики.
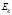 Энергия системы:
Энергия системы:
Ek - Кинетическая энергия поступательного движения системы как 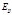 целого,
целого,
Ep -потенциальная энергия системы во внешнем поле.
U-внутренняя энергия системы.
Внутренняя энергия
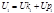 -атомов и молекул
-атомов и молекул
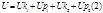
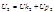 -ядер и электронов
-ядер и электронов
-энергия движения и взаимодействия всех частиц, составляющих систему.
При обычных процессах структура молекул и атомов не меняется, следовательно, U2 (ядер и электронов)=const, и рассматривают U1(атомов и молекул). При взаимодействии термодинамической системы с внешней средой её внутренняя энергия изменяется.
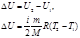
При этом возможны два способа передачи энергии:
1.процесс совершения работы,
 2. теплопередача (теплопроводность, конвекция, излучения)
2. теплопередача (теплопроводность, конвекция, излучения)
Макроскопическая (термодинамическая) работа.
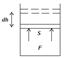
Принято считать, что если система совершает работу против действия внешних сил, то эта работа положительная. Если внешние силы совершают работу над системой, то работа отрицательная.
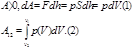

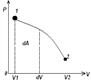 Макроскопическая работа
Макроскопическая работа
-это мера изменения внутренней энергии системы в процессе совершения работы. Работа является функцией процесса но не является функцией состояния.
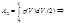
A=площади «под кривой»
Аналитическая формулировка 1 начало термодинамики
1 начало термодинамики- закон сохранения энергии для тепловых процессов 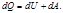
тепло, подводимое к системе, расходуется на увеличение её внутренней энергии и совершение работы против действия внешних сил.
1 н. т/д- частный случай всеобщего(фундаментального) закона сохранения энергии: 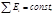
полная энергия замкнутой системы может изменяться только качественно оставаясь неизменной.
77.Изохорный процесс. (V=const)
Диаграмма этого процесса (изохора) в координатах p,V изобр-ся прямой, параллельной оси ординат
δQ=dU δA=pdV=>δA=0
Удельная теплоемкость равна кол-ву теплоты, которое небход. Затратить для нагрев. 1кг вещ-ва на 1К.
С=δQ/mdT [Дж/кг*К]
Молярная теплоемкость при V=const
Сv=δQ/νdT Cv=δQ/νdT=(ν=1; δQ=dU)=dU/dT
U=i/2kT*Na=i/2RT
Cv=i/2R-не зависит от Т, опр-ся только числом степеней свободы i


78. Изобарный процесс (p=const)
Диаграмма этого процесса в координатах p,V изобр-ся прямой параллельной оси  V. При изобарном процессе работа газа при увеличении объема от V1 до V2 равна
V. При изобарном процессе работа газа при увеличении объема от V1 до V2 равна
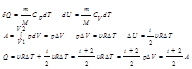
79.Изотермический процесс (T=const)
Описывается законом Бойля-Мариотта
Диаграмма этого процесса (изотерма) в координатах p,V представляет собой гиперболу, расположенную на диаграмме тем выше, чем выше температура, при которой происходит процесс.

 Следовательно, для того чтобы при расширении газа температура на понижалась, к газу в течение изотермич. процесса необходимо подводить кол-во теплоты, эквивалентное внешней работе расширения.
Следовательно, для того чтобы при расширении газа температура на понижалась, к газу в течение изотермич. процесса необходимо подводить кол-во теплоты, эквивалентное внешней работе расширения.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 537; Нарушение авторских прав?; Мы поможем в написании вашей работы!