
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ацетилен. Строение тройной связи (sp-гибридизация). Получение ацетилена карбидным способом и из метана. Химические свойства (реакции присоединения). Использование ацетилена
|
|
|
|
Общие понятия химии высокомолекулярных соединений (мономер, полимер, структурное звено, степень полимеризации). Полиэтилен. Полихлорвинил. Отношение полимеров к нагреванию, действию растворов кислот и щелочей. Использование полимеров.
Теория химического строения органических веществ. Зависимость свойств органических веществ от химического строения. Изомерия. Электронная природа химической связи в молекулах органических соединений, типы разрыва связи, понятие о свободных радикалах.
Общая характеристика элементов главной подгруппы четвертой группы периодической системы. Кремний, его физические и химические свойства. Оксид кремния и кремниевая кислота. Соединения кремния в природе. Углерод, его аллотропные формы. Химические свойства углерода. Оксиды углерода, их химические свойства. Угольная кислота, карбонаты и гидрокарбонаты, их свойства. Превращения карбонатов и гидрокарбонатов. Качественная реакция на карбонат-ион.
Общая характеристика элементов главной подгруппы пятой группы периодической системы. Фосфор. Оксид фосфора, фосфорная кислота и ее соли. Фосфорные удобрения. Азот, его физические и химические свойства. Аммиак. Физические и химические свойства. Химические основы промышленного синтеза аммиака. Соли аммония. Азотная кислота. Химические особенности азотной кислоты. Соли азотной кислоты. Азотные удобрения.
Н Н
За счет двух атомов водорода и двух несвязывающих электронных пар атома кислорода каждая молекула воды способна к образованию четырех водородных связей. Считается, что в твердой фазе все молекулы воды объединены водородными связями. При таянии льда разрывается около 15% Н-связей. При кипячении воды между ее молекулами еще остается часть Н-связей, которые полностью исчезают при нагревании водяного пара до 600ºС. Такое своеобразие в структуре воды проявляется в ее свойствах, которые отличаются рядом аномалий.
Чистая вода прозрачна и бесцветна. Она не имеет ни запаха, ни вкуса. При нормальном давлении аномально высоки температуры плавления и кипения воды по сравнению с этими показателями для соединений водорода с элементами 6А-группы, что объясняется прочностью системы водородных связей, объединяющих молекулы воды.
Вода – довольно активный химический реагент. Химическая активность воды проявляется, прежде всего, в ее высокой растворяющей способности. Вода является катализатором целого ряда химических процессов. В ее отсутствие многие вещества почти не взаимодействуют химически.
1. Кислотно-основные реакции, в которых вода ведет себя, как амфотер:
BaO + H2O → Ba(OH)2
P2O5 + 3H2O → 2H3PO4
2. Вода действует гидролитически на многие соли, образуя либо гидраты, либо продукты гидролиза:
CaCl2 + 6H2O → CaCl2·6H2O
Al2S3 + 6H2O → 2Al(OH)3↓ + 3H2S↑
3. Вода окисляет металлы, расположенные в электрохимическом ряду напряжений до олова:
2К + Н2О → 2КОН + Н2.
К 5А группе относятся элементы азот, фосфор, мышьяк, сурьма и висмут. Общая формула ВЭУ ns²np³nd° (азот - 2s²2p³). Азот представляет собой бесцветный газ, фосфор является кристаллическим веществом и существует в виде трех модификаций – белый, красный и черный, мышьяк и сурьма – металлоподобные кристаллические вещества серого цвета, висмут – серебристо-белый мягкий металл.
Азот в промышленности получают ректификацией воздуха, в лаборатории – окислением аммиака (1), реакциями внутримолекулярного окисления-восстановления соединений азота (2), восстановлением азотной кислоты (3): 1. 2NH3 + 3CuO ® N2 + 3Cu + 3H2O;
2. NH4NO2 ® N2 + H2O;
3. 5Mg + 12HNO3(p) ® N2 + 5Mg(NO3)2 + 6H2O.
Фосфор – в электрических печах по реакции:
Ca3(PO4)2 + 5C + 3SiO2 ® P2 + 3CaSiO3 + 5CO.
Мышьяк – термическое разложение арсенопирита без доступа воздуха:
FeAsS ® As + FeS.
Сурьма – сплавление сульфида сурьмы с железом:
Sb2S3 + 3Fe ® 2Sb + 3FeS.
В ряду N – Bi усиливаются металлические свойства. Азот и фосфор – типичные неметаллы; мышьяк и сурьма имеют как металлические, так и неметаллические модификации; висмут – неметалл. Устойчивость неметаллических модификаций в этом ряду падает, металлических – растет. Молекулярный азот мало активен, при комнатной температуре реагирует только с литием. При активации молекул азот окисляет многие металлы, образуя нитриды; окисляется только при взаимодействии с кислородом и фтором. Остальные элементы обладают более высокой химической активностью. Они могут окисляться и восстанавливаться, легко реагируют с рядом неметаллов и многими металлами. С кислотами-неокислителями они не реагируют, при нагревании взаимодействуют с кислотами-окислителями. При переходе от мышьяка к висмуту стабилизируется более низкая степень окисления +3; химическая связь в соединениях становиться все более ионной; основные свойства оксидов и гидроксидов усиливаются.
| N2 + H2 ® NH3 (t); Э + Г2 ® NF3; PГ3, PГ5; As, Sb, Bi – ЭГ3, ЭГ5; Э + О2 ® NО; P4О6, P4О10; As, Sb, Bi – Э2О3; Э + S ® N2; ЭxSy; P + N2 ® P3N5; Э + С ® C2N2; CP3. Э + H2SO4(k) ® HAsO2; Sb, Bi – Э2(SO4)3; Э + H2SO4(p) ® Э + NaOH ® PH3 + NaH2PO2; Na3AsO3; P + H2O ® PH3 + H3PO2; Э + HNO3(p) ® H3AsO4; Sb2O3; Bi(NO3)3; Э + HNO3(k) ® P, As – H3ЭO4, Sb2O5. |
Важнейшими элементами являются азот и фосфор. Рассмотрим более подробно их соединения. Для них известны водородные соединения состава ЭH3, а также N2H4 (гидразин), HN3, P2H4 (дифосфан). РH3 – ядовитый газ, плохо растворимый в воде. NH3 – не ядовит и хорошо растворим в воде. NH3 получают синтезом из простых веществ, а в лаборатории при реакции хлорида аммония с известью. РH3 – взаимодействием белого фосфора с концентрированным раствором щелочи. Эти вещества – сильные восстановители. Для NH3 характерны реакции присоединения за счет донорно-акцепторного взаимодействия. ЭH3 с ильными кислотами образуют соли аммония и фосфония соответственно.
Для азота известна все оксиды отвечающие СО от +1 до +5, для фосфора – степеням окисления +3 и +5. Синтезом из простых веществ при очень высоких температурах можно получить только NО, остальные оксиды азота получают косвенным путем. Р4О6 и Р4О10 можно получить при взаимодействии простых веществ. Все оксиды азота, кроме NО термически неустойчивы. N2О и NО с водой не реагируют, NО2 при растворении в воде диспропорционирует, аналогично протекает реакция со щелочами. Оксиды азота (3, 5) и фосфора (3, 5) при растворении в воде образуют соответствующие кислоты. Кислотный характер оксидов выражен тем сильнее, чем меньше атомный номер элемента и выше его СО: N2О5 – наиболее кислотный оксид. Все оксиды азота – окислители, N2О5 – сильнейший окислитель. Р4О6 – восстановитель легко окисляется кислородом, серой, галогенами.
Для азота и фосфора известны кислоты отвечающие степеням окисления +3 и +5 (для фосфора также +1 и +4). Кислоты азота в лаборатории получают действием сильных окислителей на нитраты и нитриты. Н3РО3 в лаборатории получают гидролизом хлорида фосфора. Н3РО4 – растворением соответствующего оксида в воде. Кислоты азота – сильные окислители, однако, НNО2 восстанавливается при действии только сильных восстановителей. Кислоты фосфора являются сильными восстановителями, но при действии сильных восстановителей они восстанавливаются.
Аммиак и азотная кислота используются для получения азотных удобрений, взрывчатых веществ. Фосфор и его соединения используются в производстве спичек. Роль азота и фосфора очень велика в жизни организмов. Они входят в состав молекул ДНК, с помощью которых осуществляется синтез белков и передача наследственной информации.
Фосфор повышает засухо- и морозоустойчивость, способствует накоплению ценных веществ в растении. Удобрениями служат как природные фосфорные руды, так и продукты их химической переработки. Качество фосфорных удобрении характеризуется содержанием усвояемого Р в пересчете на Р2О5.Стандартным считается удобрение, содержащее 18,9% Р2О5. Сырьем для получения служат природные фосфорные руды – фосфориты и апатиты. Фосфоритная мука – это природный измельченный фосфорсодержащий минерал. Производство состоит из операций дробления, сушки и размола фосфоритов. Суперфосфат простой получается разложением природных фосфатов серной кислотой. Простой суперфосфат содержит от 14 до 21% усвояемого Р2О5:
4Ca5(PO4)3F + 14H2SO4 + 13H2O → 6Ca(H2PO4)2·H2O + 14CaSO4·0,5H2O + HF,
Ca5(PO4)3F получают из кальцийфторапатита Ca5(PO4)3F·CaF5
Суперфосфат двойной отличается меньшим содержанием балласта и содержит в 2 – 3 раза больше усвояемого Р2О5.
Азот входит в состав хлорофилла и белков, являющихся основой живой ткани. Растения усваивают азот, содержащийся в почве в виде солей. Только некоторые растения (бобовые) усваивают азот воздуха. Основными азотными удобрениями являются: нитрат, сульфат, хлорид и фосфат аммония, калиевая, натриевая и кальциевая селитры, мочевина. Нитрат аммония – наиболее эффективное азотное удобрение, содержащее 35% азота. Получают нейтрализацией азотной кислоты сухим аммиаком:
HNO3 + NH3 →NH4NO3
Сульфат аммония содержит 21,2% азота и получается поглощением серной кислотой аммиака газа коксовых печей, нейтрализацией серной кислоты синтетическим аммиаком, обработка гипса растворами карбоната аммония:
CaSO4 + (NH4)2CO3 → (NH4)2SO4 + CaCO3
Мочевина – наиболее ценное удобрение, содержащее 46,6% азота и получаемое в промышленности из аммиака и углекислого газа:
2NH3 + CO2 → NH2COONH4 → NH2CONH2 + H2O
4А группе относятся элементы углерод, кремний, германий, олово и свинец. Углерод известен с древних времен. Он может быть получен при нагревании древесины без доступа воздуха, при обугливании животных остатков, неполном сгорании органических веществ (сажа). Графит и алмаз встречаются в природе, но в последнее время их в основном получают искусственным путем. Карбин получается синтетически при каталитическом окислении ацетилена и является наиболее стабильной формой углерода. В 1990 г. из сажи, образованной при испарении графита в электрической дуге в атмосфере гелия, была выделена новая форма С – фуллерен С60. Кремний получают восстановлением SiO2 магнием или углеродом в электрической печи. Высокой чистоты Si получают восстановлением SiCl4 цинком или водородом. Остальные элементы – термическое восстановление их оксидных соединений с помощью Н2, С, СО.
По химическим и физическим свойствам углерод и образуемые им соединения резко отличаются от др. элементов группы. Будучи типичным неметаллом, С в форме простого вещества, а также в соединениях с кислородом, азотом и серой способен образовывать кратные связи в группировках типа >C=C<, –C=C–, >C=O, O=C=O, –C=N, >C=S. Для Si и Ge соединений с подобными группировками не установлено, Sn и Pb образуют соединения, характерные для металлов. При обычных условиях все аллотропные модификации углерода весьма инертны, др. элементы группы достаточно активны и взаимодействуют со многими веществами. При увеличении температуры химическая активность всех веществ, образованных элементами группы, резко возрастает. В соединениях С и Si проявляют СО –4, +2, +4, Ge, Sn и Pb – +2, +4. Устойчивость соединений в высших СО от Si к Pb уменьшается.
Э + Н2 =
Э + Г2 = C (CF4); Si, Ge, Sn (ЭГ4); Pb (F4, Cl4, Br2, I2)
Э + О2 = ЭO2; Pb (PbO)
Э + S = C, Si, Ge, Sn (ЭS2); Ge, Sn, Pb (ЭS)
Si + N2 = Si3N4
Э + Р = Si, Ge, Sn (ЭР), ЭР2, ЭР3
Э + С =
Э + Ме = карбиды, силициды, сплавы.
Э + H2O =
Э + H2SO4(k) = C, Si; Ge, Sn (Э(SO4)2); Pb(HSO4)2
Э + H2SO4(p) = C, Si, Ge; ЭSO4 (Pb пассивируется)
Э + NaOH = C, Ge; Na2SiO3; Sn, Pb (Na2[Э(OH)4])
Э + HNO3(k) = Si; C (CO2); Ge, Sn (xЭO2·yH2O)
Э + HNO3(p) = C, Si, Ge; Sn, Pb (Э(NO3)2)
Э + HCl = C, Si, Ge; Sn, Pb (ЭCl2), (Pb пассивируется).
Наиболее важными соединениями углерода является СН4 и СО2. СН4 является химически инертным газом. Огромные его количества находятся в природе в виде природного газа. Он широко используется в различных органических синтезах, а также в быту. СО2 представляет собой газ. Он проявляет кислотные свойства, являясь ангидридом угольной кислоты. Он используется в качестве восстановителя, в пищевой промышленности для газирования различных напитков, «сухой лед». Также большое практическое значение имеют соли не выделенной в свободном состоянии угольной кислоты Н2СО3. Из соединений кремния очень важен оксид SiO2. Это кислотный оксид. Он используется как восстановитель, а также в стекольной и цементной промышленности.
В свободном виде кремний в природе не встречается, а только в соединениях, важнейшим из которых является кремнезем SiO2. Кремний также входит в состав полевого шпата и каолина. Кремнезем является главным сырьем для производства стекла, цемента и керамики. Стекло получают из смеси песка SiO2, соды Na2CO3 и известняка CaCO3, которую нагревают до 1500°С. При этом протекают реакции:
Na2CO3 + SiO2 = Na2SiO3 + CO2;
CaCO3 + SiO2 = CaSiO3 +CO2.
Затем силикаты натрия и калия сплавляют с песком и получают стекло Na2O · CaO · 6SiO2.
Если же вместо соды брать поташ К2CO3, то образуется тугоплавкое стекло К2O · CaO · 6SiO2.
Чтобы придать стеклу нужную окраску, в него добавляют соответствующие оксиды металлов: оксиды железа придают стеклу зеленый цвет, кобальта – синий, меди – голубой, серебра – желтый и т.д. Если в состав стекла входит оксид свинца, то получают хрусталь – ценное стекло, обладающее большой лучепреломляющей способностью. Хрусталь хорошо шлифуется, после чего приобретает сильный блеск.
Цемент получают из известняка и глины. При этом используют и мергель. Эту смесь обжигают в специальных печах и полученную спекшуюся массу размалывают. Он широко используется в строительстве как вяжущий материал, который при смешивании с водой затвердевает. Условно различают два типа цемента по принципу их «свертывания» - обычный цемент и портландский цемент. Процесс «схватывания» обычного цемента, состоящего из силиката кальция, происходит вследствие образования карбоната кальция за счет углекислого газа воздуха:
CaO·SiO2 + CO2 + H2O = CaCO3 + H2SiO3.
При «схватывании» портландского цемента углекислота не участвует в процессе, а происходит гидролиз силикатов с последующим образованием нерастворимых кристаллогидратов:
Ca3SiO5 + H2O = Ca2SiO4 + Ca(OH)2;
Ca2SiO4 + 4H2O = Ca2SiO4·4H2O.
Создателем теории химического строения был великий русский химик А.М.Бутлеров. Основные положения своей теории он сформулировал в 1858-1861 г.г. Некоторая трудность для нас заключается в том, что создатель теории строения не формулировал пункт за пунктом положения своей теории в одном месте: они пронизывают все научное творчество самого Бутлерова и его учеников.
1. Атомы в органических молекулах связаны друг с другом в определенном порядке химическими силами. Этот порядок Бутлеров и называл химическим строением. Во времена Бутлерова лишь в общих словах называли эти силы «силами валентности»: в наше время выяснено, что силы валентности имеют электронную природу.
2. Строение можно изучить экспериментально, используя химические методы – анализ и синтез. В наше время при установлении строения широко используют также физические методы – разные виды оптической спектроскопии, рентгенографию, электронографию, определение дипольных моментов. Физические методы, в первую очередь рентгенография и электронография, позволяют определить реальное положение каждого атома в молекуле, получать как бы его фотографию. Это расположение согласуется с найденным чисто химическим путем. Поэтому мы чаще говорим просто о строении молекул, опуская прилагательное «химическое», которое обязательно употреблял Бутлеров.
3. 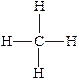
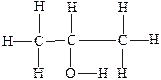 Формулы строения выражают порядок химической связи атомов. В формулах строения (структурных формулах) символы элементов соединяют черточками, условно изображающими химическую связь, например:
Формулы строения выражают порядок химической связи атомов. В формулах строения (структурных формулах) символы элементов соединяют черточками, условно изображающими химическую связь, например:

Структурные формулы в развернутой записи (т.е. с обозначением каждого атома и каждой связи) уже при небольшом усложнении молекулы становится трудно читаемыми. Поэтому с самого начала необходимо привыкнуть к структурным формулам в сокращенной записи, например:

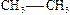
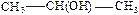 или
или
Как видно из приведенных примеров, при сокращенной записи рядом с атомом углерода помещают непосредственно связанные с ним атомы и группы, затем ставят черточку и после нее переходят к другому атому углерода, со стоящими при нем заместителями. Чтобы еще более сократить запись, иногда совсем опускают черточки: например, СН3СН(ОН)СН3.
При построении структурных формул органических соединений необходимо учитывать найденную опытным путем валентность элементов-органогенов. Так, валентность углерода 4, водорода 1, кислорода 2, галогенов 1. Азот, сера и фосфор могут находиться в разных валентных состояниях.
4. Каждое вещество имеет одну определенную формулу строения, отражающую порядок химической связи атомов в реально существующей молекуле. Это положение глубоко материалистично, философски правильно: в основе лежит реально существующий в природе объект – молекула, и структурная формула должна возможно точнее отразить этот объект. Выполнению этого требования подчинены все современные «усовершенствования» в написании формул органических веществ – введение в них обозначений электронных пар, стрелок, пунктиров, знаков заряда. Все это улучшает соответствие между формулой и реальной молекулой, т.е. отвечает принципам теории строения.
5. Связанные в молекуле атомы оказывают друг на друга взаимное влияние: свойство каждого атома в составе молекулы зависит не только от его собственной природы, но и от окружения, в котором этот атом находится. С взаимным влиянием атомов мы постоянно встречались во всем курсе органической химии. Пока ограничимся простейшим примером: и в молекуле воды, и в молекуле хлористого водорода имеется атом водорода, но сколь различны его свойства в обоих веществах!
6. Физические и химические свойства органических соединений определяются составом и строением их молекул. Во времена Бутлерова можно было судить лишь о химическом строении – порядке химической связи атомов. В настоящее время имеется возможность определять пространственное строение; определять распределение электрических зарядов – электронное строение. Все три особенности строения важны при рассмотрении свойств органических соединений.
Теория химического строения позволила понять природу изомерии: молекулы структурных изомеров имеют одинаковый состав, но различаются порядком связи атомов. Например, формула С2Н6О отвечает двум различным веществам: диметиловому эфиру и этиловому спирту.
Бутлеров не ограничился лишь теоретическим объяснении изомерии на основе теории строения. Он провел и ряд экспериментальных работ, подтвердив предсказания теории получением изобутана и третичного бутилового спирта.
Гомологический ряд предельных углеводородов (алканов), их электронное и пространственное строение, sp ³-гибридизация. Номенклатура алканов. Физические и химические свойства алканов (реакции галогенирования и окисления). Представления о механизме цепных реакций с участием свободных радикалов. Метан, его использование.
Алканы являются углеводородами, наиболее богатыми водородом, они насыщены им до предела. Отсюда название – насыщенные или предельные углеводороды. Их также называют парафинами. Общая черта в строении алканов и циклоалканов – простая или одинарная связь между атомамиуглерода. на образование этой связи затрачивается одна пара электронов, причем максимальное перекрывание орбиталей находится на линии, соединяющей центры атомов. Такую связь называют σ-связью, а электроны, образующие её – σ-электронами. Распределение электронной плотности σ‑ связи симметрично относительно оси, проходящей через центры связанных атомов. В молекулах насыщенных углеводородов атомы углерода находятся в состоянии sp³-гибридизации и каждый из них образует четыре σ-связи с углеродом или водородом. Состояние sp³-гибридизации характеризуется тетраэдрической конфигурацией, т.е. пространственное направление связей составляет 109º28’. Для алканов характерно структурное изомерия: различие в порядке связей. Для названия алканов используется рациональное номенклатура, но первые четыре представителя имеют тривиальные названия: это метан, этан, пропан, бутан. Первые четыре члена гомологического ряда являются газами, от С5 до С15 – жидкости, с С16 – твёрдые вещества. В гомологическом ряду алканов постепенно повышаются температуры кипения, плавления, а так же относительная плотность. Алканы с разветвлённой цепью кипят при более низких температурах, чем изомеры с нормальной цепью плотности всех алканов меньше единицы. Они практически не растворимы в воде, однако растворимы в эфире и других органических растворителях метан и этан практически лишены запаха, углеводороды С3 – С15 имеют хорошо известный запах бензина или керосина, высшие члены ряда лишены запаха из-за их малой летучести. В химическом отношении алканы малоактивны. Парафины вступают лишь в радикальные реакции замещения, идущие в довольно жёстких условиях. К реакциям присоединения алканы не способны!
1. Галогенирование:
CH4 + Cl2 → CH3Cl + Cl2 → CH2Cl2 + Cl2 → CHCl3 + Cl2 → CCl4 (hν)
Реакция идет по цепному механизму:
a) Инициирование цепи:
Cl2 → 2Cl∙
b) Рост цепи:
H3C:H + Cl∙ → H:Cl + H3C∙
H3C∙ +Cl:Cl → H3C:Cl + Cl∙
c) Обрыв цепи:
2Cl∙ → Cl2
2H3C∙ → CH3–CH3
H3C∙ + Cl∙ → CH3–Cl
2. Нитрование (р-ция Коновалова):
CH3CH2CH3 + HONO2 → CH3CH(NO2)CH3 + H2O (t=140°, p, 10%)
3. Крекинг: нагревание до 400°-600˚ сообщает молекулам достаточно энергии для того, чтобы произошел гомолитический разрыв С–С связи. При крекинге предельных углеводородов образуются более простые предельные и непредельные углеводороды. Наряду с собственно крекингом при термокаталитической обработке предельных углеводородов идут и другие процессы:
v Дегидрирование – отнятие водорода с превращением предельных углеводородов в непредельные.
v Ароматизация алканов и циклоалканов с превращением в ароматические углеводороды.
v Изомеризация – перестройка углеродого скелета (при действии AlCl3).
Метан используется в основном в качестве дешевого топлива. При горении он дает почти бесцветное пламя. Из метана получают ценные химические продукты: метанол, синтез-газ, формальдегид, ацетилен, различные хлорпроизводные. Этан используется при синтезе этилена. Пропан в смеси с бутаном используется в качестве топлива. Средние члены гомологического ряда используют как горючее для двигателей (бензин, керосин), а также в качестве растворителей. Высшие алканы – топливо для дизельных двигателей, смазочные масла и сырье для производства моющих средств.
Этиленовые углеводороды (алкены); σ- и π-связи, sp ²-гибридизация. Пространственная (геометрическая) изомерия. Номенклатура этиленовых углеводородов. Химические свойства (реакции присоединения водорода, галогенов, галогеноводородов, воды; реакции окисления и полимеризации). Правило Марковникова. Получение и использование этиленовых углеводородов.
Алкенами называются ненасыщенные углеводороды, содержащие в молекулах одну двойную связь. Простейшим представителем алкенов является этилен С2Н4, в связи, с чем соединения этого ряда называются также углеводородами ряда этилена. Часто применяется для них название олефины. Гомологический ряд алкенов имеет общую формулу СnН2n, т. е. как у циклоалканов. Таким образом, алкены и циклоалканы – изомеры, относящиеся к разным классам. Характерной особенностью строения алкенов является наличие в молекуле двойной связи >C=C<. Двойная связь образуется при помощи двух пар обобщенных электронов. Углеродные атомы, связанные двойной связью, находятся в состоянии sp²-гибридизации, каждый из них образует три σ-связи, лежащие в одной плоскости под углом 120º. Негибридизованные р-орбитали расположены перпендикулярно к плоскости σ-связей и параллельно друг другу и вследствие «бокового» перекрывания образуют вторую связь, называемую π-связью. Электронное облако π-связи лежит частично над плоскостью и частично под плоскостью, в которой лежат атомы. Для алкенов характерна структурная изомерия: различия в разветвлении цепи и в положении двойной связи, а также пространственная изомерия (цис- и трансизомеры). Тривиальные названия олефинов характеризуются добавлением окончания илен: этилен, пропилен и т.д., большое количество алкенов образуется при крекинге и пиролизе нефти. Другой важный способ – дегидрирование алканов (Cr2O3, t=450°–460°). Лабораторными способами получения является дегидратация спиртов и дегидрогалогенирование.
1. CH2=CH2 + Cl2 → CH2Cl–CH2Cl
2. CH3–CH=CH2 + HBr → CH3–CHBr–CH3
3. CH2=CH2 + H2O → CH3–CH2OH
4. CH2=CH2 + H2 → CH3–CH3 (Pt)
5. 3СН2=CH2 + 2KMnO4 + 4H2O → 3HOCH2CH2OH + 2MnO2 + 2КОН
Этилен является одним из важнейших полупродуктов для промышленности органического синтеза. Многие вещества, получаемые непосредственно из этилена, имеют практическое применение или используются для дальнейших синтезов. Пропилен используется для производства изопропилового спирта, ацетона, глицерина, полипропилена. Изобутилен используется для синтеза изооктана, полиизобутилена. Бутилены применяются для получения бутадиена – продукта для получения синтетического каучука.
Соединения с молекулярными массами от нескольких тысяч до миллионов получили название высокомолекулярных (полимерных). В настоящее время научились синтезировать много различных ВМС, нашедших применение для изготовления различных материалов: пластмасс, волокон, эластомеров. Для этих материалов очень важны физико-механические свойства – их прочность, эластичность, термостойкость и др. В результате изучения ВМС установлено, что их физико-механические свойства зависят, прежде всего, от формы молекулы, химический состав играет подчиненную роль. По форме молекул различают два крайних типа полимеров: линейные (нитевидные) и трехмерные (объемные, глобулярные). Существует и много др. полимеров, занимающих промежуточное положение между этими крайними типами. Характерные особенности линейных полимеров – это способность образовывать прочные волокна и пленки, значительная эластичность, способность растворяться, а при повышении температуры – плавиться. Типичные представители линейных полимеров – каучук и его синтетические аналоги, полиамидные волокна. Трехмерные полимеры не плавятся, нерастворимы, значительно менее эластичны, чем линейные полимеры, часто даже хрупки. Линейные полимеры можно превратить в трехмерные, «сшивая» цепные молекулы в пространственную сетку. Именно такой процесс происходит при вулканизации каучука. Другие типичные представители трехмерных полимеров – фенолоформальдегидные и глифталевые смолы. Конечно, не только форма, но и химическая природа макромолекулы влияет на физико-механические свойства полимера. В зависимости от состава основной цепи различают полимеры карбоцепные (полимерная цепь состоит только из атомов углерода) и гетероцепные (в состав полимерной цепи входят атомы и др. элементов). Важный класс образуют элементоорганические полимеры, в которые помимо обычных элементов-органогенов входят и атомы др. элементов – кремния, фосфора, бора, титана и др. ВМС возникают в результате соединения множества молекул низкомолекулярных веществ – мономеров. Это может осуществляться путем полимеризации или поликонденсации. Соответственно полимеры по способам получения разделяют на полимеризационные и поликонденсационные. Реакция полимеризации заключается в присоединении друг к другу большого числа молекул мономеров. Реакции полимеризации идут за счет присоединения к кратным связям или за счет раскрытия циклов. Цепной реакции дает толчок кокой-то инициатор. Инициатором часто служат вещества, легко распадающиеся на свободные радикалы. Большое значение в технике имеет совместная полимеризация смеси мономеров: такой процесс называется сополимеризацией. Меняя состав смеси мономеров, можно тонко регулировать свойства получаемых материалов.
Полиолефины. Особое значение приобрела полимеризация олефинов, при которой образуются ценные высокомолекулярные материалы.
Полиэтилен – это по существу насыщенный углеводород с молекулярной массой от 20 тысяч до миллиона. Он представляет собой прозрачный материал, обладающий высокой химической стойкостью, температура размягчения 100-130°С, предел прочности при растяжении 120-340 кг/см², имеет низкую тепло- и электропроводность.
CH2=CH2 → ∙∙∙–CH2–CH2–CH2–CH2–CH2–CH2–∙∙∙
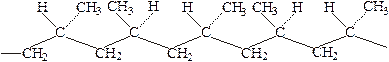
Полипропилен получают из пропилена аналогично полиэтилену. Это прозрачный материал с температурой размягчения 160-170°С, предел прочности при растяжении 260-500 кг/см², обладающий хорошими электроизоляционными свойствами. Особенностью полимеризации является получение нескольких видов строения молекулы: атактический полимер (1), синдиотактический полимер (2), изотактический полимер (3):


Полистирол – бесцветный прозрачный материал, хорошо известный в виде различных изделий из «органического стекла». Температура размягчения атактического полистирола ~85°С, а изотактического 230°С, что позволяет использовать последний при более высоких температурах. Строение изотактического полистирола следующее:

Виниловые полимеры. Кроме углеводородов, способны полимеризоваться и многие другие соединения с двойной связью, носящие название виниловых мономеров. Их общая формула CH2=CH–X, где Х – хлор, CN, COOCH3 и др. Формула получаемых полимеров следующая:
∙∙∙–CH2–CH–CH2–CH–CH2–CH–CH2–CH–∙∙∙
| | | |
X X X X
Поливинилхлорид – прочный термопластичный материал, молекулярная масса 300–400 тысяч. При обычной температуре это твердый материал, однако его можно сделать мягким и гибким, смешивая с труднолетучими растворителями, так называемыми пластификаторами.
Широко используются полиметилакрилат (1)и полиметилметакрилат (2), получаемые из эфиров ненасыщенных кислот – акриловой и метакриловой.
1. nCH2=CH → ∙∙∙–CH2–CH–CH2–CH–CH2–CH–∙∙∙
| | | |
COOCH3 COOCH3 COOCH3 COOCH3
CH3 CH3 CH3 CH3
| | | |
2. nCH2=C → ∙∙∙–CH2–CH–CH2–CH–CH2–CH–∙∙∙
| | | |
COOCH3 COOCH3 COOCH3 COOCH3
Ценные материалы получаются при полимеризации нитрила акриловой кислоты (акрилонитрила):
nCH2=CH → ∙∙∙–CH2–CH–CH2–CH–CH2–CH–∙∙∙
| | | |
CN CN CN CN
Из полиакрилонитрила изготавливается волокно нитрон – искусственная шерсть.
 Поливинилацетат.
Поливинилацетат.
–CH2–CH–
|
O–CO–CH3
В реакции поликонденсации участвуют обычно бифункциональные мономеры, молекулы которых присоединяются друг к другу с отщеплением какой-либо простой молекулы (обычно воды).
Полиамиды:
Анид получают из адипиновой кислоты и гексаметилендиамина:
nHOOC–(CH2)4–COOH + nH2N–(CH2)6–NH2 ®
→ [–OC–(CH2)4–CO–NH–(CH2)4–NH–]n + nH2O
Капрон получается из капролактама:
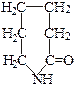 |
→ ∙∙∙–NH–(CH2)5–CO–NH–(CH2)5–CO–NH–(CH2)5–CO–∙∙∙
Энант получают при конденденсации ω-аминоэтановой кислоты. Это волокно имеет строение:
∙∙∙–NH–(CH2)6–CO–NH–(CH2)6–CO–NH–(CH2)6–CO–∙∙∙
Полиэфиры. При поликонденсации дикарбоновых кислот с многоатомными спиртами получают высокомолекулярные материалы полиэфирного типа.
Лавсан – полиэфир этиленгликоля и терефталевой кислоты:
 |
 HOOC– –COOH + HOCH2–CH2OH →
HOOC– –COOH + HOCH2–CH2OH →
→ ∙∙∙–O–CH2–CH2–O–OC– –CO–∙∙∙
Глифталевые смолы получаются при поликонденсации глицерина и фталевой кислоты. Наличие трех гидроксильных групп дает возможность для построения трехмерного полимера:

Вместо глицерина можно применять и пентаэритрит С(СН2ОН)4 (пентафталевые смолы). Наряду с фталевой кислотой вводят также насыщенные и ненасыщенные жирные кислоты. Глифталевые, пентафталевые смолы и продукты их модификации различными добавками объединены под общим названием алкидные смолы. Их растворяют в различных органических растворителях, добавляют красители и получают эмали и лаки, применяемые для окраски вагонов, станков, сельскохозяйственных машин. Алкидные смолы употребляют также при изготовлении типографических красок, линолеума, клеев. В этих областях применения имеет значение способность алкидных смол после высыхания давать прочные пленки.
Фенолоформальдегидные смолы. Искусственный материал, полученный поликонденсацией фенола с формальдегидом, явился первой пластмассой, полученной еще в прошлом столетии, но сохранившей свое значение и в наше время. По фамилии изобретателя англичанина Бакеленда этот материал получил название бакелит.
Поликонденсация фенола с формальдегидом проходит при длительном нагревании компонентов в присутствии кислотных или основных катализаторов. Сначала образуется прозрачная желтоватая жидкость, содержащая метилольные производные фенола. Эти продукты при дальнейшем нагревании конденсируются друг с другом, первоначально образуя малоразветвленный полимер типа:

Молекулярная масса нарастает постепенно. Если поликонденсацию остановить при достижении молекулярной массы 700 – 1000, то получается резол – твердая, очень хрупкая прозрачная масса, напоминающая янтарь. Этот материал легко растворяется в органических растворителях.
Такие растворы используют в качестве лаков. При повышении температуры до 60-90°С резол плавится, его применяют для изготовления пресспорошков.  Рис.1
Рис.1
В процессе прессования идет дальнейшая поликонденсация резольной смолы с образованием трехмерного полимера – резита (см. рис. 1). Резит не плавится и не растворяется.
Диеновые углеводороды, их строение, химические свойства и использование. Природный каучук, его строение и свойства. Синтетический каучук.
Алкадиены – соединения, содержащие в открытой углеродной цепи две двойные связи. Общая форма алкадиенов СnН2n-2 (как и ацетиленов). Следовательно, алкадиены изомерны алкинам. Изомерия алкадиенов в свою очередь обусловлена строением углеродного скелета и относительным расположением двойных связей. По взаимному расположению двойных связей различают следующие алкадиены: с кумулированными двойными связями (С=С=С), с сопряженными двойными связями (С=С–С=С), с изолированными двойными связями (С=С–С–С–С=С). Наиболее промышленно важными алкадиенами являются бутадиен-1,3 и изопрен. Промышленными способами получения бутадиена-1,3 является дегидрирование бутана, а также по способу Лебедева (из этанола); изопрена – дегидрирование изобутилена. Как и для алкенов, для алкадиенов характерны реакции полимеризации и присоединения. Наиболее практически важными являются реакции полимеризации, т.к. в их основе лежит получение синтетических каучуков. При полимеризации изопрена получают полимер, похожий по строению элементарного звена на природный каучук.
nCH2=CH–CH=CH2 ® (–CH2–CH=CH–CH2–)n
nCH2=CH–CH(CH3)=CH2 ® (–CH2–C(CH3)=CH–CH2–)n
Чтобы получить каучук с определенными свойствами, часто используют реакцию сополимеризации – совместной полимеризации двух и более полимеров. Каучуки широко применяются в производстве резины. Чтобы превратить каучук в резину, его наполняют сажей, глиной и подвергают вулканизации. Вулканизация – сшивание различных цепей полимера. Чаще всего вулканизируют каучук с целью повышения прочности, эластичности, снижения растворимости.
Алкины – ненасыщенные углеводороды, содержащие в молекуле одну тройную связь. Общая формула – СnH2n-2. Главным фактором, характеризующим алкины, является наличие в молекуле тройной связи
– С ≡ С –
Углеродные атомы, образующие тройную связь, находятся в состоянии sp-гибридизации. Каждый из них образует две σ-связи, две негибридизованные р-орбитали расположены под прямым углом друг к другу и соответствующим орбиталям другого атома. Они попарно перекрываются, образуя две π-связи, расположенные в двух взаимно перпендикулярных плоскостях. Изомерия алкинов обусловлена разветвлением цепи и положением тройной связи: в этом у них сходство с алкенами. Но для алкинов невозможно существование цис-транс -изомеров, т.к. две σ-связи лежат на одной прямой. Основные способы получения: из дигалогенпроизводных алканов отщеплением галогенводорода при действии спиртового раствора КОН, взаимодействием алкилгалогенидов с ацетиленидами.
1. CH≡CH + Cl2 → CHCl=CHCl
CHCl=CHCl+ Cl2 → CHCl2–CHCl2
2. CH≡СH + HF → CH2=CHF
3. CH≡CH + H2 → CH2=CH2 + H2 → CH3–CH3
4. CH≡CH + HOH → [CH2=CHOH] → CH3CHO
Реакция протекает легче, чем для алкенов. Катализатором служит разбавленная серная кислота и соли двухвалентной ртути. Эта реакция была открыта М. Г. Кучеровым в 1881 г. и носит его имя.
На основе ацетилена развились многие отрасли промышленности органического синтеза.
|
|
|
|
|
Дата добавления: 2015-04-24; Просмотров: 3147; Нарушение авторских прав?; Мы поможем в написании вашей работы!