
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Алгоритми розв’язків задач
|
|
|
|
Тема заняття: ТЕОРІЯ БРЕНСТЕДА – ЛОУРІ. БУФЕРНІ СУМІШІ
Мета проведення: закріпити теоретичні знання з даної теми через розв’язування задач на розрахунок рН розчинів кислот та основ, буферних сумішей
Після виконання роботи студент повинен:
Знати: протолітичну теорію Бренстеда – Лоурі, приклади буферних сумішей
Вміти: визначатирН розчинів кислот, основ та буферних сумішей
Матеріально – технічне оснащення робочого місця: таблицяконстант йонізації кислот і основ, таблиця наближених значень середніх коефіцієнтів активності f при різних значеннях йонної сили розчину
1. Визначити концентрацію водневих і гідроксильних іонів, якщо pOH розчину рівний 4,34.
Розв'язування
pH + pOH = 14; звідки pH = 14 - pOH, pH = 14 - 4,34 = 9,66. Якщо pH =-lg[H+], то [H+] = 10–pH = 10–9,66 = 2,2· 10–10 (моль/л)
[OH–] можна визначити двома способами:
Kw 10–14
а) [OH–] = ¾¾¾ = ¾¾¾¾ = 4,6· 10–5 (моль/л);
[H+] 2,2· 10–10
б) Якщо pOН=4,34, а pOH= -lg[OH–], то [OH–] = 10–pOH= 10–4,3 = 4,6·10–5 (моль/л)
Відповідь: 2,2·10–10; 4,6· 10–5 (моль/л).
2. Розрахувати pH 0,20 М розчину ортофосфатної кислоти
Розв'язування
Оскільки константи дисоціації H3PO4 за різними стадіями значно відрізняються, то дисоціацією за другою і третьою стадією можна знехтувати. Оцінюємо ступінь дисоціації H3PO4:
__________ ___________
a = Ö Kк-ти/Ск-ти =Ö7,08·10–3/0,2 ·100% = 19%
Тому [H3PO4] ¹ Cк-ти і розрахунки ведуть за формулою
[H+] = 1/2(-KHAn + 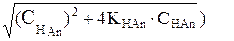
________________________
[H+] = 1/2(-7,08·10–3 + Ö(7,08·10–3)2+4•7,08·10–3·0,2) = 2,33·10–2M;
pH = -lg[H+] = 1,63
Відповідь: 1,63.
3. Визначити pH і ступінь дисоціації 0,1 н. розчину оцтової кислоти.
Розв'язування
CH3COOH Û H+ + CH3COO–, [H+] =[CH3COO–]
[H+] · [ CH3COO–] [H+]2
К(CH3COOH) = ¾¾¾¾¾¾¾¾ = ¾¾¾¾¾¾.
[CH3COOH] [CH3COOH]
__________ __________
[H+] = Ö Kк-ти•Ск-ти = Ö 1,77•10–5•0,1 = 1,3•10–3 (моль/л); pH = -lg[H+] = 2,9
[ CH3COO–] [ H+]
a = ¾¾¾¾¾¾ = ¾¾¾¾¾ = 1,3•10–2 = 1,3 %
[CH3COOH] [CH3COOH]
Відповідь: 2,9; 1,3 %.
4. Скільки грамів HCOONa треба додати до 100 мл 0,2 М HCl, щоб одержати буферний розчин з pH 4,3?
Розв'язування
Коли додати достатню кількість HCOONa до HCl:
HCOONa + HCl = HCOOH + NaCl
Тому С(HCOOH) = С(HCl) = 0,2 М, pH = 4,3;
pH=-lg[H+], то [H+]=10–pH=10–4,3= 5•10–5 (моль/л)
HCOOH Û H+ + HCOO–
0,2-5•10–5 5•10–5 5•10–5+C(HCOONa)
[H+]•[ HCOO–]
К(HCOOH) = ¾¾¾¾¾¾ = 1,8•10–4
[HCOOH]
[HCOOH] = 0,2 - 5•10–5» 0,2 (моль/л)
[ HCOO–]=5•10–5 + C(HCOONa)» C(HCOONa), тому
5•10–5• C(HCOONa)
¾¾¾¾¾¾¾¾¾ =1,8•10–4; C(HCOONa)=0,72 M
0,2
За рівнянням взаємодії HCOONa з HCl витрачається 0,2 моль/л HCOONa. Загальна концентрація доданого натрій форміату дорівнює 0,2 + 0,72 = 0,92 (моль/л).
В 100 мл розчину є 0,92 моль HCOONa,
в 1000 мл - х моль HCOONa.
х=9,2 (моль/л), m(HCOONa) = n•М= 9,2•68 =6,2 (г)
Відповідь: 6,2 г
5. Розрахувати pH 0,1М розчину NaHCO3.
Розв'язування
[HCO3-] >>K(H2CO3) і K(HCO3-) • [HCO3-] >> Kw, тому
__________________ ____________
[H+] = ÖK(H2CO3)•K(HCO3-) = Ö 7•10–7• 6•10–11 =
= 2,05•10–10 M pH = 9,69
Відповідь: 9,69.
6. Розрахувати pH суміші, в якій загальні концентраціїї бензенова і амінобензенової кислот відповідно рівні 0,20М і 0,02М.
Розв'язування
Різниця у величинах констант дисоціації обидвох кислот вирівнюється великою різницею концентрацій.
K(С6H5COOH) = 1,62•10-6; K(С6H4NH2COOH) = 1,1•10-5, тому
______________________ _______________________
[H+] = Ö K1 •[HAn1] + K2 •[HAn2] =Ö1,62•10-6•0,2+1,1•10-5•0,02 =
_______________
=Ö3,24•10-7+2,2•10-7 = 7,35•10-4М; pH = -lg[H+] = -lg 7,35•10-4 = 3,13
Відповідь: 3,13.
7. Розрахувати ступінь гідролізу і pH в 0,1 М розчині Na2CO3.
Розв'язування
Внаслідок гідролізу розчин Na2CO3 має лужну реакцію:
CO32– + H2O Û HCO3– + OH– (І ступінь);
HCO3– + H2O Û H2CO3 + OH– (ІІ ступінь).
Концентрацією іонів [OH–], які одержуються за другим ступенем гідролізу, можна знехтувати, так як гідроліз тут майже не проходить.
[OH–] •[ HCO3–]
Кгідр. = ¾¾¾¾¾¾, домножуємо чисельник і знаменник на [ H+]:
[CO32–]
[OH–] •[ HCO3–] •[ H+] [OH–]•[ H+] Kw 10–14
Кгідр. = ¾¾¾¾¾¾¾¾¾ = ¾¾¾¾¾ = ¾¾¾ = ¾¾¾ = 1,7•10–4
[CO32–] •[ H+] К2 К2 6•10–11
Згідно рівняння гідролізу [ HCO3–] = [OH–]; [CO32–] = C (Na2CO3) = 0,1 (моль/л)
[OH–]2 [OH–]2
¾¾¾¾¾¾ = Kгідр.; ¾¾¾¾¾ = 1,7•10–4
C (Na2CO3) 0,1
[OH–] = 4•10–3; pOH = -lg4•10–3 =2,4 pH = 14 - pOH = 11,6
Ступінь гідролізу (aгідр) дорівнює відношенню концентрації гідролізованої соди (рівної [OH–]) до загальної концентрації CM(Na2CO3):
[OH–] 4•10–3
aгідр. = ¾¾¾¾¾ = ¾¾¾ = 0,04 = 4%
CM(Na2CO3) 0,1
Відповідь: 11,6; 4%.
Зміст завдань для самоконтролю
1. Визначити pH, pOH і [OH–] для розчинів, в яких [H+] дорівнює 4•10–3 (моль/л).
2. Визначити [H+], [OH–] і pH для розчинів, для яких pOH = 8,34.
3. Визначити де значення pH є більшим, в: a) 0,01 н розчині HNO3 чи в 0,01 н розчині CH3COOH; б) 0,1 М NaOH чи 0,1 М NH4OH?
4. Визначити pH 0,1 н розчину ціанідної кислоти.
5. Розрахувати pH: a) 0,2 М розчину бензоатної кислоти; б) 1,00 М розчину форміатної кислоти.
6. Визначити pH 0,5 н. розчину NH4OH.
7. Визначити pH 0,04 н. розчину H2SO4, вважаючи дисоціацію кислоти повною.
8. Визначити pH 0,005 н. розчину KOH, прийнявши ступінь дисоціації KOH рівним 100%.
9. Розрахувати концентрацію [OH–] іонів у розчині з pH 12,2.
10. Розрахувати pH 0,1 М розчину сульфітної кислоти;
11. У скільки разів зміниться (збільшиться чи зменшиться) концентрація [H+] при збільшенні pH на: а) 1; б) 0,2?
12. Визначити pH 0,01 н. розчину ацетатної кислоти, якщо ступінь її дисоціації дорівнює 4,2%.
13. Визначити концентрацію іонів [H+] і pH розчину, 1 л якого містить 0,03 моль CH3COOH і 0,001 моль CH3COONa.
14. Визначити концентрацію іонів [OH–] і pH розчину, 1 л якого містить 0,5 моль NH4OH і 0,1 моль NH4Cl.
15. Визначити концентрацію іонів [OH–]. [H+] і pH розчину, 1 мл якого містить 0,15 моль NH4OH і 0,05 моль NH4NO3.
16. Яка молярна концентрація розчину HCOOH, рH якого дорівнює 3?
17. Визначити молярну концентрацію розчину HCN, рH якого дорівнює 5?
18. При якій концентрації CH3COOH продисоціює на 8 %?
19. Концентрація іонів [H+] в розчині CH3COOH 10–4 моль/л. Визначити молярну концентрацію розчину.
20. Концентрація іонів [H+] в 0,1 М розчині CH3COOH 1,3•10–3 моль/л. Визначити константу і ступінь дисоціації кислоти.
21. Розрахувати pH розчину, який містить 3 г/л ортоборатної кислоти.
22. Розрахувати pH 0,01М водних розчинів: а) фосфатної кислоти; б) натрій дигідрогенфосфату; в) натрій гідрогенфосфату; д) натрій фосфату.
23. Розрахувати концентрацію ацетатної кислоти у винному оцті (pH = 2,8), якщо прийняти, що кислотність його визначається тільки ацетатною кислотою.
24. Є зразок лимонного соку з pH 2,0. Розрахувати загальну концентрацію лимонної кислоти, якщо кислотність соку надає тільки вона.
25. Розрахувати pH 0,2 M розчину піридину.
26. Розрахувати pH 0,1М розчину барій гідроксиду.
27. Розрахувати pH 2•10–4М розчину кальцій гідроксиду.
28. Визначити pH розчину, який одержали розчиненням у 2 л води 23 г HCOOH і 21 г HCOOK.
29. Визначити pH розчину, який одержали розчиненням у100 мл 0,0375 М розчину CH3COOH 0,102 г CH3COONa..
30. Визначити pH розчину, в 1 л якого міститься 60,05 г CH3COOH і 82,03 г CH3COONa.
31. Визначити константу дисоціації H2CO3, якщо pH 0,1М розчину Na2CO3 дорівнює 11,65 (дисоціацією за другим ступенем знехтувати).
32. Визначити константу дисоціації HNO2, якщо pH 0,1 М розчину NaNO2 дорівнює 8,15.
33. Визначити pH розчину, коли ступінь гідролізу в: а) 0,5 М розчині CH3COONa дорівнює 3%;б) 0,05 М КNO2 - 5%.
34. Скільки грамів KCN містять 10 мл розчину, pH якого дорівнює 11,1?
35. Розрахувати pH 0,20М розчину амоній хлориду.
36. Чому дорівнює pH і ступінь гідролізу в 0,05 М розчині Na2CO3 ?
37. В 500 мл розчину містяться 2,52 г Na2CO3. Визначити pH і ступінь гідролізу.
38. В 250 мл розчину містяться 0,535 г NH4Cl. Визначити pH і ступінь гідролізу.
39. Скільки грамів NH4Cl міститься в 1 л розчину, якщо pH його 5,8?
40. При якій молярній концентрації NH4NO3 розчин має pH 5,6?
41. Визначити константу дисоціації HCN, якщо 0,2 М розчин NH4CN має pH 9,23.
42. Визначити константу дисоціації HCOOH, якщо 0,1 М розчин HCOONH4 має pH 6,5.
43. Розрахувати співвідношення молярних концентрацій кислоти і солі в амоніачному буферному розчині з pH 9,00.
44. Cкільки грамів твердого натрій гідроксиду треба додати до 100,0 мл 0,10М розчину амоній хлориду, щоб одержаний буферний розчин мав pH 9,75?
45. Розрахувати співвідношення молярних концентрацій натрій гідрогенфосфату і фосфату в буферному розчині з pH 7,20.
46. Визначити рН в 0,3 М розчині NaH2PO4.
47. 0,1 н. розчин HCl був нейтралізований на 80% 0,1 н розчином NaOH. Враховуючи розведення розчину, знайти значення pH одержаного розчину.
48. Розрахувати значення pH для 0,01 н. розчину ацетатній кислоти.
55. Яке повинно бути співвідношення HCOOН і HCOONa у розчині форміатної буферної суміші, щоб pH її дорівнював 2,25?
49. Визначити pH буферної суміші, яка містить 0,01М CH3COOH і 0,01М CH3COOК.
50. Розрахувати pH буферної суміші, яка містить 0,5М CH3COOH і 0,01М CH3COONa.
51. Визначити концентрацію Н+ і рН розчину, який в 1 л містить 0,06 мольCH3COOH і 0,02 моль CH3COONa.
52. В 1 л розчину міститься 2,5608 г оцтової кислоти. Визначити концентрацію Н+-іонів і ступінь дисоціації кислоти.
53. До 250 мл 0,4 M HCN додали 250 мл 0,4 М NaOH. Визначити рН розчину і ступінь гідролізу солі.
54. Визначити рН 1%-ного розчину NaOH, якщо r=1,0 г/мл.
55. Яка концентрація розчину аміаку, якщо NH4OH в ньому продисоціював на 8%?
Рекомендована література:[7, 8]
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 29485; Нарушение авторских прав?; Мы поможем в написании вашей работы!