
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Алгоритми розв’язків задач. Мета проведення:закріпити теоретичні знання з даної теми через зображення структурних формул фенолів
|
|
|
|
Тема заняття: ОКСИГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ
Мета проведення: закріпити теоретичні знання з даної теми через зображення структурних формул фенолів, спиртів, альдегідів, кетонів, карбонових кислот, естерів, жирів та складання рівнянь реакції, що відображають хімічні властивості вищезгаданих органічних сполук
Після виконання роботи студент повинен:
Знати: класифікацію і номенклатуру оксигеновмісних органічних сполук, їх фізичні та хімічні властивості, застосування в товарознавстві та харчовій промисловості
Вміти: зображати структурні формули оксигеновмісних органічних сполук та складати рівняння реакції, що відображають хімічні властивості даних сполук
Матеріально – технічне оснащення робочого місця: періодична система хімічних елементів Д.І. Менделєєва,кодоплівки з даної теми
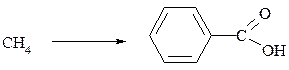
1. ßê ç ìåòàíó îäåðæàòè áåíçîéíó êèñëîòó?
Ðîçâ’ÿçóâàííÿ
1). ϳðîë³çîì ìåòàíó îäåðæóºìî àöåòèëåí:
10000C
2CH4 ¾¾® C2H2 + 3H2
2) Àöåòèëåí òðèìåðèçóþòü:
àêò.Ñ
3Ñ2Í2 ¾¾® Ñ6Í6
5000Ñ
3) Ç áåíçîëó îäåðæóþòü òîëóîë (ìåòèëáåíçîë):
ÀlÑl3
Ñ6Í6 + ÑÍ3Ñl ¾¾® Ñ6Í5ÑÍ3 + ÍѲ
4) Îäåðæàíèé ìåòèëáåíçîë îêèñëþþòü ó êèñëîìó ñåðåäîâèù³ ñèëüíèìè îêèñíèêàìè (KMnO4):
KMnO4,H+
Ñ6Í5ÑÍ3 + [O] ¾¾¾® C6H5COOH
2. Âóãëåâîäåíü â³äíîñèòüñÿ äî ðÿäó àëêåí³â. Âèâåñòè éîãî ôîðìóëó, çíàþ÷è, ùî 0,21 ã ö³º¿ ðå÷îâèíè ìîæóòü ïðèºäíаòè 0,8 ã áðîìó.
Ðîçâ’ÿçóâàííÿ
| Äàíî: m(ÑnÍ2n)=0,21ã m(Br2)=0,8 ã ÑnÍ2n –? | Àëêåíè ïðèºäíóþòü ëèøå îäíó ìîëåêóëó áðîìó: 0,21 ã 0,8 ã 160·0,21 ÑnÍ2n+Br2 ® ÑnÍ2nBr2; õ = ¾¾¾¾ =42 (ã/ìîëü); õ ã 160 ã 0,8 Ar(C) = 12; Ar(H) = 1 12n + 2n = 42, 14n = 42, n = 3. Îòæå, öå ïðîïåí ÑÍ2=ÑÍ–ÑÍ3 ³äïîâ³äü: ÑÍ2=ÑÍ–ÑÍ3 |
3. ×îìó ð³âíèé ñòóï³íü ïîë³ìåðèçàö³¿ ïîë³ïðîï³ëåíó, ÿêùî éîãî ìîëåêóëÿðíà ìàñà 315000?
Ðîçâ’ÿçóâàííÿ
| Äàíî: Ìr(–ÑÍ2–ÑÍ–)n=315000 ÑÍ3 n –? | Ìîëåêóëÿðíà ìàñà ïîë³ìåðó äîð³âíþº äîáóòêó ñòóïåíÿ ïîë³ìåðèçàö³¿ íà ìîëåêóëÿðíó ìàñó åëåìåíòàðíî¿ ëàíêè. Ìr(–ÑÍ2–ÑÍ–)= 42 (ã/ìîëü) ÑÍ3 Ì ïîë³ìåðó 315000 n = ¾¾¾¾¾¾ = ¾¾¾¾ = 7500 Ì åëåì. ëàíêè 42 ³äïîâ³äü: 7500 |
4. ϳä ÷àñ âçàºìî䳿 áóòàíîëó–1 ç íàäëèøêîì ìåòàë³÷íîãî íàòð³þ âèä³ëèâñÿ âîäåíü, ÿêèé çà íîðìàëüíèõ óìîâ çàéìຠîá'ºì 2,8 ë. Ñê³ëüêè áóòàíîëó ïðîâçàºìîä³ÿëî?
Ðîçâ’ÿçóâàííÿ
| V(H2) = 2,8 ë í.ó. m(C4H9OH)–? | Çàïèñóºìî ð³âíÿííÿ ðåàêö³¿: õ ìîëü 2,8 ë 2C4H9OH + 2Na ® 2C4H9ONa + H2 2 ìîëü 22,4 ë Çà í.ó. ìîëü áóäü–ÿêîãî ãàçó çàéìຠîá'ºì 22,4 ë Ïðè âçàºìî䳿 2 ìîë³â áóòàíîëó âèä³ëÿºòüñÿ 22,4ë Í2, ïðè âçàºìî䳿 õ ìîë³â áóòàíîëó – 2,8 ë Í2 2·2,8 õ = ¾¾¾¾ = 0,25 (ìîëü); 22,4 m = n·M(C4H9OH) = 0,25·74 = 18,5 (ã) ³äïîâ³äü: 18,5 ã |
5.  ðåàêö³¿ "ñð³áíîãî äçåðêàëà" 0,18 ã àëüäåã³äó â³äíîâèëè 0,54 ã ñð³áëà.
Âèçíà÷èòè ôîðìóëó àëüäåã³äó.
Ðîçâ’ÿçóâàííÿ
| m(R–COH)=0,18 ã m(Ag) = 0,54 ã M(Ag)=108ã/ìîëü RCOH –? | 0,18 ã 0,54 ã R–ÑÎH + Ag2O ® R–ÑOÎH + 2Ag Mr (2·108) ã Ìr = 0,18·216/0,54 = 72 Ìr(R–) = Ìr(R–COH) – Ìr(–COH) =72–29= 43 Îñê³ëüêè R – ÑnH2n+1, òî 12n + 2n +1=43; n = 3, îòæå ðàäèêàë – Ñ3Í7(ïðîï³ë), à àëüäåã³ä Ñ3Í7ÑÎÍ Â³äïîâ³äü: Ñ3Í7ÑÎÍ |
Зміст завдань для самоконтролю
1–7. Íàïèñàòè ñòðóêòóðí³ ôîðìóëè ³çîìåðíèõ ñïîëóê, íàçâàòè ¿õ çà ñèñòåìàòè÷íîþ íîìåíêëàòóðîþ.
1. ñïèðò³â ñêëàäó C5H11OH;
2. êèñëîò ñêëàäó C5H10O2;
3. ñêëàäíèõ åô³ð³â ñêëàäó C4H8O2;
4. êèñëîò ñêëàäó C6H12O2;
5. àëüäåã³ä³â ³ êåòîí³â ñêëàäó C4H8O;
6. ñïèðò³â ñêëàäó C6H13OH;
7. àëüäåã³ä³â ñêëàäó C5H10O;
8–15. Ñêëàñòè ñòðóêòóðí³ ôîðìóëè íàñòóïíèõ ñïîëóê:
8. 2–áðîìïðîïàíîë–1; 2–ìåòèëïåíòàíîë–2; áóòèëàöåòàò;
9. 2,6–äèìåòèëîêòàä³îë–2,6; 2–ìåòèëãåêñàíàëü; åòàíîâà êèñëîòà;
10. 2–ìåòèë–3–åòèëãåêñàíîë–3; 2,2–äèìåòèëáóòàíàëü; ìåòàíîâà êèñëîòà;
11. 2–ôåí³ëáóòàíîë–2; 2–ìåòèëïðîïàíàëü; äèåòèëîâèé åô³ð;
12. 2–ìåòèëïåíòàíîë–3; 2,3,4–òðèìåòèëïåíòàíàëü; åòèëàöåòàò;
13. 2,5–äèìåòèëãåêñàíîë–3; ïåíòàíàëü; 2–ìåòèëïðîïàíîâà êèñëîòà;
14. 5–ìåòèëãåêñàíîë–3; 2,3–äèìåòèëáóòàíàëü; 3–åòèëãåêñàíîâà êèñëîòà;
15. 2–åòèëôåíîë; 2–ìåòèëïåíòàíàëü; 2,3,4–òðèõëîðáóòàíîâà êèñëîòà.
16–23. Çàïèñàòè ð³âíÿííÿ ðåàêö³é â³äïîâ³äíèõ ïåðåòâîðåíü:
16. ßê ç àöåòèëåíó îäåðæàòè áåíçàëüäåã³ä?
17. ßê ç ïðîïàíîëó îäåðæàòè ïðîï³îíàò íàòð³þ?
18. ßê ç ïðîïàíîëó îäåðæàòè äèõëîðïðîïàí?
19. ßê ç áóòàíîâî¿ êèñëîòè îäåðæàòè ïðîïàí?
20. ßê ç ïðîï³íó îäåðæàòè ïðîïàíîí?
21. ßê ç ãëþêîçè îäåðæàòè åòèëàò íàòð³þ?
22. ßê ç ïðîï³íó îäåðæàòè ïðîïàíîë–2?
23. ßê ç àöåòèëåíó îäåðæàòè îöòîâó êèñëîòó?
24. Íà íåéòðàë³çàö³þ 100 ã ðîç÷èíó ôåíîëó âèòðà÷åíî 0,5 ã ã³äðîêñèäó íàòð³þ.
ßêà ìàñîâà äîëÿ ôåíîëó â âèõ³äíîìó ðîç÷èí³?
25. ßêó ê³ëüê³ñòü îöòîâîãî àëüäåã³äó ìîæíà îäåðæàòè ç 500 ì3 àöåòèëåíó (í.ó.),
ÿêùî ïðàêòè÷íèé âèõ³ä àëüäåã³äó ñêëàäຠ90%?
26. ßêà ê³ëüê³ñòü êàðá³äó êàëüö³þ, ùî ì³ñòèòü 20% äîì³øîê, íåîáõ³äíà äëÿ
îäåðæàííÿ 80 êã îöòîâîãî àëüäåã³äó?
27. Ñê³ëüêè ãðàì³â ìàãí³þ ïîòð³áíî äëÿ âèä³ëåííÿ ç îöòîâî¿ êèñëîòè 5 ìîë³â
âîäíþ (í.ó.)?
28. Îöåò º 8%–íèì ðîç÷èíîì oöòîâî¿ êèñëîòè. Ñê³ëüêè íåîáõ³äíî 80%–íî¿
îöòîâî¿ êèñëîòè äëÿ ïðèãîòóâàííÿ 5 êã îöòó?
29.  ðåçóëüòàò³ âçàºìî䳿 96 ã îöòîâî¿ êèñëîòè ç åòèëîâèì ñïèðòîì óòâîðèëîñÿ
116 ã ñêëàäíîãî åô³ðó. ßêèé âèõ³ä åô³ðó â ïðîöåíòàõ?
30.ßêèé îá'ºì çàéìå ÑÎ2 (í.ó.), ùî âèä³ëèòüñÿ ïðè áðîä³íí³ 450 ã ãëþêîçè?
31. Ïðè ñïàëþâàíí³ 0,93 ã îðãàí³÷íî¿ ðå÷îâèíè óòâîðèëîñÿ 672 ìë âóãëåêèñëîãî
ãàçó (í.ó.), 1,35 ã âîäè ³ àçîò. Ãóñòèíà ðå÷îâèíè çà ïîâ³òðÿì ð³âíà 1,07. Âèçíà÷èòè
ñêëàä ðå÷îâèíè ³ íàïèñàòè ñòðóêòóðíó ôîðìóëó.
32. Ïðè â³äíîâëåíí³ í³òðîáåíçîëó ìàñîþ 73,8 ã äîáóëè àí³ë³í ìàñîþ 48,0 ã.
Âèçíà÷èòè âèõ³ä ïðîäóêòó.
33.ϳä ÷àñ áðîä³ííÿ ãëþêîçè äîáóëè 276 ã åòàíîëó, âèõ³ä åòàíîëó ñòàíîâèâ
80%. ßêó ìàñó ãëþêîçè ï³ääàëè áðîä³ííþ?
34. Напишіть утворення етилпропіонату за реакцією естерифікації.
35. За допомогою яких реакцій можна відрізнити етиловий спирт, 1,2-етандіол і фенол? Запишіть відповідні рівняння реакцій.
36.За допомогою яких якісних реакцій можна відрізнити етаналь та 2-пропанон? Запишіть відповідні рівняння реакцій.
37. Напишіть реакції утворення бутану з таких сполук: а) пропіонової кислоти, б) 1-хлороетану (за реакцією Вюрца).
38. Напишіть утворення етилпропіонату за реакцією естерифікації.
39. За допомогою яких реакцій можна відрізнити етиловий спирт, 1,2-етандіол і фенол? Запишіть відповідні рівняння реакцій.
40.За допомогою яких якісних реакцій можна відрізнити етаналь та 2-пропанон? Запишіть відповідні рівняння реакцій.
41. Що утвориться під час окиснення пропену розбавленим та концентрованим розчином перманганату калію? Напишіть рівняння відповідних реакцій.
42 Здійснити перетворення та назвати проміжні продук:
43 Здійснити перетворення та назвати проміжні продук:

44 Здійснити перетворення та назвати проміжні продук:
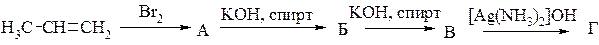
Рекомендована література:[9 - 15]
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 426; Нарушение авторских прав?; Мы поможем в написании вашей работы!