
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема заняття: нітрогеновмісні органічні сполуки
|
|
|
|
Мета проведення: закріпити теоретичні знання з даної теми через зображення структурних формул нітрогеновмісних органічних сполук та складання рівнянь реакції, що відображають хімічні властивості органічних сполук даного класу
Після виконання роботи студент повинен:
Знати: класифікацію і номенклатуру нітрогеновмісних органічних сполук, їх фізичні та хімічні властивості, застосування в товарознавстві та харчовій промисловості
Вміти: зображати структурні формули нітрогеновмісних органічних сполук та складати рівняння реакції, що відображають хімічні властивості даних сполук
Матеріально – технічне оснащення робочого місця: періодична система хімічних елементів Д.І. Менделєєва,кодоплівки з даної теми
Теоретичні відомості:
Амінокислоти – похідні карбонових кислот, у яких один із гідрогенів вуглецевого ланцюга заміщений на аміногрупу (- NН2).
Замінні амінокислоти – можуть синтезуватися в організмі людини із інших азотовмісних сполук, наприклад: гліцин, аланін, серін, пролін, тирозин, аспарагінова і глутамінова кислоти, цистин, цистеїн та ін.
Незамінні амінокислоти – не можуть синтезуватися в організмі людини. До них належать такі амінокислоти: валін, лізин, лейцин, ізолейцин, треонін, метіонін, триптофан, фенілаланін.
Деякі найбільш важливі α-амінокислоти
| Формула | Систематична назва | Триві- альна назва | Скорочена назва |
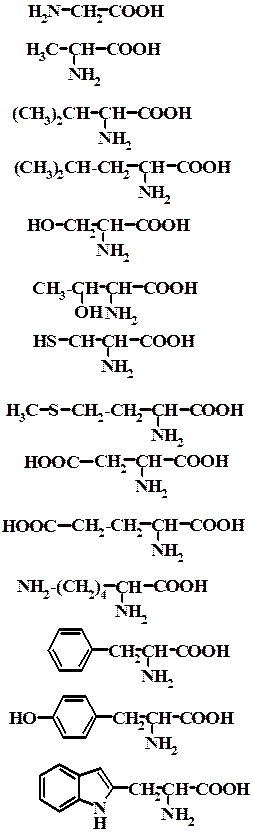
| Аміноетанова кислота 2-Амінопропанова кислота 2-Аміно-3-метил- бутанова кислота 2-Аміно-4-метил- пентанова кислота 2-Аміно-3-гідрокси- пропанова кислота 2-Аміно-3-гідрокси- бутанова кислота 2-Аміно-3-меркапто- пропанова кислота 2-Аміно-4-метил- меркаптобутанова кислота 2-Амінобутандіова кислота 2-Амінопентандіова кислота 2,6Діаміногексанова кислота 2-Аміно-3-феніл пропанова кислота 2-Аміно-3-(n-гідроксифеніл) пропанова кислота 2-Аміно-3-(2-індоліл) пропанова кислота | Гліцин α-Аланін Валін Лейцин Серин Треонін Цистеїн Метіонін Аспарагіно-ва кислота Глутаміно-ва кислота Лізин Феніл-аланін Тирозин Триптофан | Gly Ala Val Leu Ser Tre Cys Met Asp Glu Lys Phe Tyr Try |
Білки – азотовмісні високомолекулярні органічні сполуки (полімери), які складаються із α-амінокислот (мономери), що послідовно з’єднані між собою пептидними зв’язками. Вони є найважливішими компонентами живих організмів. Кожен білок унікальний за своєю структурою і функціями.
Повноцінний білок – містить у своєму складі усі незамінні амінокислоти.
Неповноцінний білок – містить у своєму складі не усі незамінні амінокислоти.
Амфотерність білкових молекул – здатність проявляти кислий або основний характер.
Ізоелектрична точка білка (ІЕТ) – значення рН середовища, при якому білок не несе сумарного заряду, тобто число негативних зарядів зрівнюється з числом позитивних зарядів.
Колоїдний характер водних розчинів білка – обумовлюється високомолекулярністю і великим діаметром білкових молекул (> 0,001 мкм; 1 мкм = 10-6м). Протоплазма, яка у великій мірі складається з води і білків, є колоїдною системою. Молекули колоїдного розчину одного білка мають однаковий заряд і тому відштовхуються, не з’єднуються у великі агрегати і не осаджуються. Вони повільно дифундують, не здатні проникати через напівпроникні мембрани, розсіюють світло, мають велику в’язкість.
Гелі (драглі) – при певних умовах усі колоїдні розчини можуть втрачати текучість і утворювати гелі (драглі). Вони виникають у результаті об’єднання молекул у вигляді сітки, внутрішній простір якої заповнений великою кількістю розчинника, але при цьому розділення на рідку і тверду фази не відбувається, як у випадку коагуляції.
Набухання гелів (драглів) – збільшення об’єму за рахунок зв’язування великої кількості води. Це спостерігається при проростанні насіння, намочуванні крупи, виготовленні тіста та ін.
Синерезис – явище, зворотне до набухання, тобто відокремлення води від гелю, наприклад, при довгому зберіганні кефіру.
Розчинність білків – велика спорідненість з водою (гідрофільність). Це пов’язано з гідратацією білкової молекули у результаті взаємодії диполів води з йонними (-NН2 і –СООН) і полярними (-ОН, -NН, -СО) групами в білковій молекулі. Така вода навколо білкової молекули називається структурованою.
Висолювання – процес осадження білка нейтральними солями. При цьому руйнується гідратна оболонка і нейтралізуються заряди білкової молекули. Такі білки зберігають свої природні властивості і функції після видалення солі.
Емульгуючі властивості білка – білок утворює на поверхні крапель жиру (за рахунок гідрофобної взаємодії) тонку плівку, яка притягує воду (за рахунок полярних груп) і протидіє злипанню жирових часток.
Денатурація – під дією різних фізичних і хімічних факторів порушується природна просторова структура білкової молекули: руйнуються четвертинна, третинна і вторинна структури (первинна не змінюється). Це призводить до зменшення або повної втрати розчинності, специфічної біологічної активності, зміни оптичних властивостей, в’язкості та ін. При денатурації розриваються іонні, водневі і дисульфідні зв’язки, поліпептидний ланцюг розкручується і знаходиться або в розгорнутому стані, або у вигляді хаотичного клубка.
Каталітичні (ферментативні) білки – ферменти, під дією яких прискорюються і регулюються усі хімічні перетворення в живих організмах, є простими або складними білками.
Структурні (опорні) білки – беруть участь у побудові мембран усіх клітин, входять до складу з’єднувальних і кісткових тканин (колаген), волосся, нігтів, шкіри (кератин).
Скорочувальні (рухаючі) білки – у живій природі любі форми руху (робота м'язів, рух протоплазми в клітині і ін.) здійснюється білковими комплексами. Так, у процесі м’язового скорочення і розслаблення важливу роль відіграють специфічні білки м’язової тканини актин і міозин. Молекули цих білків здатні щільно зжимати і розслаблювати свою структуру, використовуючи хімічну енергію, яка накопичується в сполуках, багатих на енергію.
Енергетичні білки – при окисленні 1г білку утворюється приблизно 4,0 ккал енергії (16,8 кДж).
Регуляторні білки – входять до складу різних біологічно активних речовин: гормонів; медіаторів, які виділяються в області нервових закінчень, та ін.
Рецепторні білки – здатні вибірково „пізнавати” і приєднувати речовини. Білки – рецептори клітинної мембрани після зв’язування певних сполук передають інформацію в середину клітини і іншим клітинам. На такому принципі базується органолептика (сприйняття різних подразнень органами відчуття: смаку, запаху).
Гомеостатичні білки – забезпечують сталість внутрішнього середовища організму (гомеостаз), так як вони мають амфотерні властивості і є частиною буферних систем крові.
Травні білки – каталізують травлення харчових речовин на простіші сполуки в шлунково-кишковому тракті, так як ферменти є білками, наприклад, амілаза, пепсин, трипсин, ліпаза і ін.
Транспортні білки – переносять багато речовин через клітинні мембрани. Такі білки містяться у рідкій частині крові. Так, наприклад, альбуміни транспортують ліпіди, вітаміни, йони металів, гормони. Гемоглобін переносить кисень по крові від легень до тканин і органів, а вуглекислий газ – від органів і тканин до легень.
Захисні білки – захищають організм проти впливу шкідливих для життєдіяльності факторів. Основну функцію захисту у людини виконує імунна система, яка забезпечує синтез специфічних білків – антитіл у відповідь на бактерії, токсини і ін. чужорідні речовини (антигени). При цьому утворюється комплекс „антиген-антитіло”. Звертання крові, яке запобігає кровотечам, базується на перетворенні білків крові фіброгену і тромбіну. Внутрішні стінки стравоходу і шлунку вистелені захисним шаром слизистих білків муцинів.
Зміст завдань для самоконтролю
1.Що таке білки?
а)високомолекулярні полімери,побудовані із АК(амінокислот),зв’зані пептидними зв’язками;
б)високомолекулярні азотовмісні сполуки,що утворюють колоїдні розчини;
в)полі конденсати АК;
г)гетерогенні високомолекулярні сполуки мононуклеотидів.
2.Які елементи входять до складу білків?
а)карбоген,гідроген,оксиген,сірка;
б)карбоген,гідроген,оксиген,фосфор;
в)карбоген,гідроген,оксиген,нітроген,сірка,фосфор,залізо;
г)карбоген,оксиген,сірка,фосфор,йод,залізо.
3.Які АК належать до моноамінодикарбованих?
а)Ліз,НО-Ліз,Арг,Орн;
б)Глу,Асп;
в)Ала,Вал,Лей,Ілей;
г)Глу,Асп,Ліз,Арг.
4.Які АК є постійною складовою частиною білків?
а)Ала,ГАМК;
б)ЦИС,Цин,Орн,Цит,Гомо цистеїн;
в)Вал,Ала,Сер,Глу;
г)Орн,Карнозин,карнітин,ансерин.
5.Які АК містять сірку?
а)Сер,Тир,Тре,Цис;
б)Вал,Лей,Іле,Тре;
в)Три,Гіс,Про;
г)Мет,Цис,Цин.
8.Які групи є постійними в АК?
а)аміногрупа,карбоксильна;
б)аміногрупа,гідроксильна;
в)карбоксільна,метальна;
г)аміногрупа,метальна,гідроксильна.
10.Які АК мають по дві карбоксильні групи?
а)Про,Сер,Мет;
б)Вал,Ілей,Тре;
в)Арг,Ліз,Вал;
г)Глу,Асп.
11.Яка АК має сульфгідрильну групу?
а)Цис;
б)Гли;
в)Мет;
г)Сер.
15.Якими групами АК зв’язані у пептидному ланцюзі?
а)карбоксильними,гідроксильними й аміногрупами;
б)карбоксильна група однієї АК зв’язана з аміногрупою іншої;
в)сульфгідрильними групами;
г)водневими,ковалентними,електронними та іншими зв’язками.
16.Що таке первинна структура білків?
а)унікальна послідовність АК-залишків у поліпептидному ланцюзі;
б)кількісний склад АК у молекулі білка;
в)розташування поліпептидного ланцюга в просторі;
г)певне чергування внутрішньомолекулярних зв’язків у білках.
17.Що є характерним для вторинної структури білків?
а)взаємне розташування поліпептидних ланцюгів всередині білкової молекули з утворенням спіралей;
б)конфірмаційні взаємозв’язки пептидних ланцюгів;
в)просторова конфігурація поліпептидного ланцюга в білковій молекулі;
г)просторова спіралеподібна конфігурація поліпептидного ланцюга
18.Що таке третинна структура білків?
а)взаємне розташування активних груп АК у пептидному ланцюзі;
б)просторова упаковка спіралей,тобто вторинних структур у молекул активного білка;
в)активна структура білка,зумовлена водневими зв’зками пептидних ланцюгів;
г)асоціація білкових і небілкових субодиниць у макромолекулах білків.
19.Що таке четвертинна структура білків?
а)об’єднання кількох білкових одиниць і небілкових молекул третинної структури в активні білкові міцели;
б)конфірмаційні структури білка;
в)розташування вторинних структур у просторі білкової молекули;
г)специфічна конформація,характерна для білків з порівняно низькою молекулярною масою.
20.Що означає термін «конформація білка»?
а)це асоціація двох або більше третинних структур у макромолекулі білка;
б)сума всіх зв’зків у білкових молекулах;
в)просторова біологічна активна архітектоніка білкової молекули,утворена за певних умов середовища;
г)розташування активних груп білка в тривимірному просторі за певних значень рН середовища.
21.Для яких білків характерні β-спіральні структури?
а)фібрилярних(колаген,кератин);
б)глобулярних;
в)багатих на Про і НО-Про;
г)багатих на Глу та Арг.
23.Що таке денатурація білків?
а)повна втрата білками гідрофобних властивостей і набуття гідрофільних;
б)повна втрата білками нативних властивостей з подальшим порушенням їх специфічної макроструктури;
в)значне порушення всіх ковалентних зв’язків у білковій молекулі;
г)порушення первинної структури білків зі збереженням унікальної укладки поліпептидного ланцюга в просторі.
24.Чому розчинні білки є колоїдними?
а)розмір білкових часток не перевищує 1мм(10-9 м);
б)мають високу молекулярну масу,розмір білкових часток коливається від 0,001 до 0,1 мкм(10-6-10-9 м);
в)мають низьку в’язкість і високий осмотичний тиск;
41.Що таке ізоелектрична точка білків?
а)стан білків,у якому їх молекула стає негативно зарядженою;
б)значення рН середовища,за якого білок стає найбільш іонізованим;
в)значення рН,за якого заряд білка наближається до нуля,білок не переміщується в електричному полі,легко денатурується;
г)значення рН середовища,за якого білок має розчинність.
42.Що таке ефект Тіндаля?
а)поява променів під час проходження світла через справжній розчин;
б)поява конусу світла під час пропускання пучка світла через колоїдний розчин білків;
в)випадання білків в осад в ізоелектричній точці;
г)перехід білка із гідрофільного в гідрофобний стан.
43.Що таке гідроліз білків?
а)розщеплення білків на АК або пептиди за участі води під дією низки факторів;
б)ферментативний розпад білків на АК;
в)кислотне розщеплення білків на складові частини;
г)розпад білкових структур шляхом кип’ятіння у лужному середовищі.
44.Які білки належать до складних?
а)фосфопротеїни,метал протеїни,глікопротеїни,ліпопротеїни,ферменти,нуклеопротеїди тощо;
б)альбуміни,глобуліни,протаміни,ліпопротеїни;
в)фосфатиди,хромопротеїни,альбуміни,колаген,протеїноіди;
г)метало протеїни,хропротеїни,глобуліни,актоміозин.
Рекомендована література:[9 - 15]
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 1915; Нарушение авторских прав?; Мы поможем в написании вашей работы!