
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ентальпія системи. Теплові ефекти. Екзо- та ендотермічні процеси
|
|
|
|
Ентальпі́я (або теплова функція, від грец. enthálpo — «нагріваю») — повна енергія системи, яка складається із внутрішньої енергії і добутку тиску на об'єм. Позначається 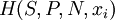 або
або 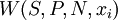 , де N — число частинок системи, xi — інші макроскопічні параметри системи. Ентальпія — адитивна функція, тобто ентальпія всієї системи дорівнює сумі ентальпій її складових частин. Із внутрішньою енергією E системи ентальпія зв'язана співвідношенням:
, де N — число частинок системи, xi — інші макроскопічні параметри системи. Ентальпія — адитивна функція, тобто ентальпія всієї системи дорівнює сумі ентальпій її складових частин. Із внутрішньою енергією E системи ентальпія зв'язана співвідношенням:
 ,
,
де U - внутрішня енергія, P - тиск, V - об'єм.
Тепловий ефект хімічної реакції або зміна ентальпії системи внаслідок перебігу хімічної реакції - віднесене до зміни хімічної змінної кількість теплоти, отримане системою, в якій пройшла хімічна реакція і продукти реакції взяли температуру реагентів.
Щоб тепловий ефект був величиною, яка залежить тільки від характеру протікає хімічної реакції, необхідне дотримання наступних умов:
· Реакція повинна протікати або при постійному обсязі Q v (ізохорний процес), або при постійному тиску Q p (ізобарний процес).
· У системі не відбувається ніякої роботи, крім можливої при P = const роботи розширення.
Якщо реакцію проводять при стандартних умовах при Т = 298,15 К = 25 ˚ С і Р = 1 атм = 101325 Па, тепловий ефект називають стандартним тепловим ефектом реакції або стандартної ентальпії реакції Δ H r O. В термохимии стандартний тепловий ефект реакції розраховують за допомогою стандартних ентальпій освіти.
Екзотермічна реакція - хімічна реакція, що супроводжується виділенням теплоти. Протилежна ендотермічний реакції.
Повна кількість енергії в хімічній системі надзвичайно важко виміряти або підрахувати. З іншого боку, зміна ентальпії ΔH в хімічній реакції набагато легше виміряти або порахувати. Для цих цілей використовують калориметри. Виміряне значення ΔH співвідноситься з енергією зв'язку молекул наступним чином:
ΔH = енергія, витрачена на розрив зв'язків (Енергія розриву хімічного зв'язку) - енергія, виділена при утворенні зв'язків продуктів реакції.
Для екзотермічних реакцій ця формула дає від'ємне значення для ΔH, так як більше значення віднімається з меншого значення. При згорянні водню, наприклад: 2H2 + O2 → 2 H2O
зміна ентальпії ΔH = -483.6 кДж на один моль O2.
Ендотермічні реакції (від др.-греч. Ἔνδον - всередині і θέρμη - тепло) - хімічні реакції, що супроводжуються поглинанням теплоти. Для ендотермічних реакцій зміна ентальпії і внутрішньої енергії мають позитивні значення (\ Delta H> 0, \ Delta U> 0), таким чином, продукти реакції містять більше енергії, ніж вихідні компоненти.
До ендотермічної реакції відносяться:
реакції відновлення металів з оксидів,
електролізу (поглинається електрична енергія),
електролітичної дисоціації (наприклад, розчинення солей у воді),
іонізації,
фотосинтезу.
Ендотермічні реакції протилежні екзотермічним реакцій.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 3444; Нарушение авторских прав?; Мы поможем в написании вашей работы!