
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Швидкість хімічної реакції та фактори, що на неї впливають. Правило Вант-Гоффа
|
|
|
|
Іонний добуток води. Поняття про водневий та гідроксильний показники. Поняття про індикатори.
Вода дисоціює за рівнянням:
H2O ↔ H + + OH-
Константа її дисоціації рівна:
K = [H +] [OH-] / [H2O]
Вода - дуже слабкий електроліт, тому концентрація [Н20] залишається практично постійною при дисоціації, а отже, залишається постійною і величина
Kw = [H +] [OH-]
яка називається іонним добутком води. Іонний добуток води залежить тільки від температури: при 25 ° С Kw = 1 * 10-14.
У дістіл.воді
[Н +] = [ОН-] = √ 10-14 = 10-7 моль / л.
У кислих розчинах [Н +]> 10-7 моль / л, в нейтральних [Н +] = 10-7 'моль / л. в лужних [Н +] <10 "моль / л.
Для опису кислотності розчину використовують водневий показник (рН), який визначається як
pH =-lg [H +]
У кислих розчинах рН <7, в нейтральних рН = 7, в лужних рН> 7.
Дисоціація кислот і підстав. Одноосновні кислоти дисоціюють у водному розчині по рівнянню
HA ↔ H + + A-
де A-- кислотний залишок. Константа дисоціації рівна
Ka = [H +] [A-] / [HA]
де індекс a {acid) позначає кислотний тип дисоціації.
Кислотно-основні індикатори - органічні сполуки, здатні змінювати колір в розчині при зміні кислотності (pH). Індикатори широко використовують у титруванні в аналітичній хімії і біохімії. Їх перевагою є дешевизна, швидкість і наочність дослідження. Однак через суб'єктивності визначення кольору та невисокої точності індикатори pH не завжди зручні; тому для точного вимірювання pH використовують pH-метри з цифровою індикацією.
Швидкість хімічної реакції - зміна кількості одного з реагуючих речовин за одиницю часу в одиниці реакційного простору. Є ключовим поняттям хімічної кінетики. Швидкість хімічної реакції - величина завжди позитивна, тому, якщо вона визначається по вихідному речовині (концентрація якого убуває в процесі реакції), то отримане значення множиться на -1.
Наприклад для реакції: 
вираз для швидкості буде виглядати так: 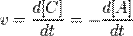
У 1865 році Н. Н. Бекетовим і в 1867 році Гульдберг і Вааге був сформульований закон діючих мас:
Швидкість хімічної реакції в кожен момент часу пропорційна концентраціям реагентів, зведеним ступеня, рівні їх стехіометричним коефіцієнтам.
Для елементарних реакцій показник ступеня при значенні концентрації кожної речовини часто дорівнює його стехиометрическому коефіцієнту, для складних реакцій це правило не дотримується. Крім концентрації на швидкість хімічної реакції впливають наступні фактори:
природа реагуючих речовин,
наявність каталізатора,
температура (правило Вант-Гоффа),
тиск,
площа поверхні реагуючих речовин.
Якщо ми розглянемо найпростішу хімічну реакцію A + B → C, то ми помітимо, що миттєва швидкість хімічної реакції величина непостійна. Правило Вант-Гоффа — емпіричне правило, яке дозволяє в першому наближенні оцінити вплив температури на швидкість протікання хімічної реакції в невеликому температурному інтервалі (зазвичай від 0 °C до 100 °C). Я. Г. Вант-Гофф на основі багатьох експериментів сформулював наступне правило: При збільшенні температури на кожні 10 градусів константа швидкості гомогенної елементарної реакції збільшується в два-чотири рази.
Правило описується наступним рівнянням:

де  - швидкість реакції при температурі
- швидкість реакції при температурі 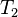 ,
, 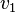 — швидкість реакції при температурі
— швидкість реакції при температурі 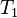 , y — температурний коефіцієнт швидкості реакції (якщо він, наприклад, дорівнює 2, то швидкість реакції буде збільшуватись в 2 рази при збільшенні температури на 10 градусів).
, y — температурний коефіцієнт швидкості реакції (якщо він, наприклад, дорівнює 2, то швидкість реакції буде збільшуватись в 2 рази при збільшенні температури на 10 градусів).
Правило Вант-Гоффа має обмежену область застосування. Багато реакцій йому не підкоряються, наприклад реакції, що відбуваються при високих температурах, дуже швидкі та дуже повільні реакції.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 758; Нарушение авторских прав?; Мы поможем в написании вашей работы!