
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Поняття про ентропію. Рівняння Больцмана. Енергія Гіббса
|
|
|
|
Закон Гесса. Наслідок із закону Гесса.
Закон Гесса - математичний наслідок першого початку термодинаміки, яке формулюється наступним чином:
• Тепловий ефект хімічної реакції, що проводиться в ізобарно-ізотермічних або ізохорно-ізотермічних умовах, залежить тільки від виду та стану вихідних речовин і продуктів реакції і не залежить від шляху її протікання.
Іншими словами, кількість теплоти, що виділяється або поглинається при якому процесі, завжди одне і те ж, незалежно від того, чи протікає дане хімічне перетворення в одну або в декілька стадій (за умови, що температура, тиск і агрегатні стани речовин однакові). Наприклад, окислення глюкози в організмі здійснюється по дуже складних багатостадійних механізму, однак сумарний тепловий ефект всіх стадій даного процесу дорівнює теплоті згоряння глюкози.
Закон відкритий російським хіміком Г. І. Гессом у 1840 р.; він є окремим випадком першого початку термодинаміки стосовно до хімічних реакцій. Практичне значення закону Гесса полягає в тому, що він дозволяє розраховувати теплові ефекти найрізноманітніших хімічних процесів; для цього зазвичай використовують ряд наслідків з нього.
Наслідки із закону Гесса
• Тепловий ефект прямої реакції дорівнює за величиною і протилежний за знаком тепловому ефекту зворотної реакції (закон Лавуазьє - Лапласа).
• Тепловий ефект хімічної реакції дорівнює різниці сум теплот утворення (ΔHf) продуктів реакції і вихідних речовин, помножених на стехіометричні коефіцієнти (ν):
• Тепловий ефект хімічної реакції дорівнює різниці сум теплот згоряння (ΔHc) вихідних речовин і продуктів реакції, помножених на стехіометричні коефіцієнти (ν):
Таким чином, користуючись табличними значеннями теплот утворення або згоряння речовин, можна розрахувати теплоту реакції, не вдаючись до експерименту.
Поняття ентропії було вперше введено у 1865 році Рудольфом Клаузіусом. Він визначив зміну ентропії термодинамічної системи при оборотному процесі як відношення загальної кількості теплоти ΔQ, отриманої або втраченої системою, до величини абсолютної температури T:

Рудольф Клаузіус дав величині S назву «ентропія», утворивши її від грецького слова τρoπή, «зміна» (зміна, перетворення).
Рівність відноситься саме до зміни ентропії. У термодинаміці ентропія визначається лише з точністю до сталої.
Зв'язок між теплоємністю та ентропією дається формулою

У 1877 році, Людвіг Больцман зрозумів зв'язок між ентропією системи та кількістю можливих «мікростанів» (мікроскопічних станів), якими може реалізуватися макроскопічний стан із заданими властивостями. Розглянемо, наприклад, ідеальний газ у посудині. Мікростан визначений як положення та імпульси кожного атома, з яких складається система. Братимемо до уваги тільки ті мікростани, для яких: (i) розташування всіх частинок не виходить за межі посудини, (ii) загальна енергія газу, що визначається як сума кінетичних енергій атомів, дорівнює певній величині. Больцман постулював що
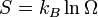
де константа kB=1,38·10-23 Дж/К відома тепер як стала Больцмана, а  є числом мікроскопічних станів, можливих у заданому макроскопічному стані. Цей постулат, відомий як принцип Больцмана, може розцінюватися, як початок статистичної механіки, яка описує термодинамічні системи використовуючи статистичну поведінку.
є числом мікроскопічних станів, можливих у заданому макроскопічному стані. Цей постулат, відомий як принцип Больцмана, може розцінюватися, як початок статистичної механіки, яка описує термодинамічні системи використовуючи статистичну поведінку.
Ене́ргія Гі́ббса, або потенціа́л Гі́ббса — це термодинамічний потенціал такого вигляду:  де
де  — внутрішня енергія,
— внутрішня енергія,  — тиск,
— тиск,  — об'єм,
— об'єм,  — абсолютна температура,
— абсолютна температура,  — ентропія.
— ентропія.
Енергію Гіббса можна розуміти як повну хімічну енергію системи (кристала, рідини тощо)
Поняття енергії Гіббса широко використовується в термодинаміці та хімії.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 816; Нарушение авторских прав?; Мы поможем в написании вашей работы!