
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Молекула
|
|
|
|
АТОМ
Атомно-молекулярного вчення
НАЙВажливіші поняття
Основні положення атомно-молекулярної теорії
ОСНОВНІ ПОНЯТТЯ І ЗАКОНИ ХІМІЇ
Самостійна робота
| N з/п | Назва теми | |
| Поняття і закони хімії | ||
| Будова електронної оболонки атома | ||
| Хімічний зв’язок | ||
| Хімічний зв'язок у комплексних сполуках | ||
| Сплави металів | ||
| Класифікація хімічних реакцій | ||
| Походження природного газу і кам’яного вугілля | ||
| Походження нафти | ||
| Риформінг і піроліз | ||
| Термодинаміка | ||
| Радіоактивність | ||
| Реальні гази. Газоподібний стан | ||
| Метали і напівпровідники | ||
| Каталіз | ||
| Розчини. Теорія електролітичної дисоціації | ||
| Вимірювання електрорушійної сили | ||
| Електроліз | ||
| Молекулярно-кінетичні властивості колоїдних розчинів | ||
| Поверхневі явища | ||
| Адсорбція | ||
| Властивості золей | ||
| Властивості колоїдних розчинів та їх приготування | ||
| Предмет аналітичної хімії. Загальні відомості | ||
| Теоретичні основи аналітичної хімії | ||
| Методи якісного аналізу | ||
| Аналіз речовини | ||
| Розрахунки в ваговому аналізі | ||
| Титриметрія. Трилонометрія | ||
| Розрахунки об’ємного аналізу | ||
| Спектральний аналіз |
1 Основні положення атомно-молекулярної теорії
2 Найважливіші поняття атомно-молекулярного вчення
2.1 Атом
2.2 Молекула
2.3 Хімічний елемент
2.4 Прості та складні сполуки
3 Основні закони хімії
3.1 Закон збереження маси і енергії
3.2 Закон сталості складу
3.3 Закон об’ємних співвідношень Гей-Люссака
3.4 Закон Авогадро
3.5 Основні газові закони
3.6 Закон еквівалентів
4 Приклади розв’язання типових задач
5 Висновки
6 Запитання для самоперевірки
Згідно з сучасними уявленнями основні положення атомно-молекулярної теорії зводяться до наступних тез:
- Речовини мають дискретну природу. Вони складаються з частинок (структурних елементів речовини) – молекул, атомів, йонів;
- Частинки речовин безперервно рухаються;
- Між частинками речовини діють сили взаємного притягання і відштовхування;
- Між складовими частинками речовини є відстані, розмір яких залежить від агрегатного стану;
- Молекули складаються із атомів;
- Молекули зберігаються при фізичних явищах і руйнуються під час хімічних реакцій;
- Атоми під час хімічних процесів залишаються неподільними, але перегрупуються, внаслідок чого утворюються нові сполуки;
- Різноманітність речовин у природі зумовлена різними сполученнями атомів, завдяки чому можуть виникати речовини з молекулярною або немолекулярною будовою.
Згідно з атомно-молекулярним вченням, головними об’єктами хімії є атоми, молекули, хімічні елементи, прості та складні речовини.
Атоми – хімічно неподільні частинки, що зберігаються під час хімічних реакцій,але при цьому частково може змінюватися будова електронної оболонки. Проте атоми руйнуються у процесі ядерних реакцій.
Атом – це найменша, хімічно неподільна, електронейтральна частинка елемента, яка складається з позитивно зарядженого ядра і негативно зарядженої електронної оболонки.
| Атом – це система, що складається з ядра і електронної оболонки (рис.1.1). До складу атомного ядра, радіус якого у 10000 разів менший (10–14–10–15м) за радіус атома (~10–10м), входять ядерні частинки нуклони. Нуклони – це позитивно заряджені протони й електронейтральні нейтрони. Електронна оболонка, розмір якої визначає радіус усього атома, – це сукупність електронів. Позитивний заряд ядра визначається кількістю протонів і дорівнює за абсолютною величиною негативному заряду електронної оболонки, який відповідає кількості електронів.Завдяки рівності за абсолютною величиною зарядів протонів і електронів атом є електронейтральним. Протони, нейтрони і | 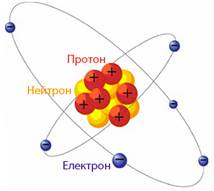 Рисунок 1.1 – Спрощена модель будови атома и атомного ядра
Рисунок 1.1 – Спрощена модель будови атома и атомного ядра
|
електрони об’єднуюються спільною назвою – субатомні частинки.
Маси протону і нейтрону практично однакові, а маса електрона у 1836 разів менше, тому уся маса атома фактично зосереджена в його ядрі. З цієї причини густина речовини в ядрі фантастично велика – порядку 1013–1014г/см3. Маси атомоврізних елементів коливаються від 1,67·10–27кг (атом гідрогену) до 4,42·10–25кг (атом мейтнерію – елемента № 109).
Кількісними характеристиками атома є заряд ядра і відносна атомна маса А r. Ці величини зазначаються у періодичній системі елементів. Заряд ядра атома дорівнює порядковому номеру елемента (закон Мозлі).
Оскільки маси атомів дуже малі, в хімії впроваджена позасистемна одиниця вимірювання, яка називається атомною одиницею маси (а.о.м.) і дорівнює одній дванадцятій маси атома ізотопу карбону–12 (m(атома12С) = 19,92·10–27кг):
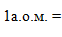
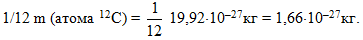
Відносна атомна маса Аr – це фізична величина, що дорівнює відношенню середньої маси атома елемента до однієї дванадцятої маси атома ізотопу карбону-12:
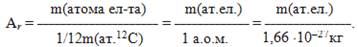
У системі вимірювань СI Аr – безрозмірна величина. Позасистемна одиниця вимірювання відносної атомної маси – а.о.м. Абсолютна маса атома дорівнює добутку його відносної атомної маси на 1/12 маси атома карбону –12, наприклад:
m(ат.О)=А r (О)·1,66·10–27 = 16·1,66·10–27 = 26,56·10–27кг.
Атом є носієм хімічних властивостей елемента. Разом з цим у атомів одного елемента можуть бути різні маси внаслідок явища ізотопії, при якому атоми одного елемента містять однакову кількість протонів у ядрі, але різну кількість нейтронів, що позначається на їх масі.
Молекули – це реально існуючі природні об’єкти, що підтверджується багатьма експериментально доведеними фактами.
Молекула – це найменша частинка речовини, яка здатна самостійно існувати і має всі хімічні властивості речовини.
Як матеріальні частинки молекули мають розміри і маси. Розміри молекул коливаються у межах 10–10–10–7м. Маса окремої молекули надзвичайно мала. Так, маса молекули води складає 2,895·10–26кг.
Молекула зберігає хімічні властивості речовини. Відомо, що речовина характеризується певними фізичними і хімічними властивостями. Фізичні властивості – це агрегатний стан, густина, температури кипіння і плавлення, електропровідність, діелектрична проникність, колір, запах, смак тощо. Зрозуміло, що перелічені властивості речовин можуть бути притаманні не одній молекулі, а досить великій їх сукупності. Однак молекула має й власні фізичні властивості: дипольний та магнітний моменти, здатність до поляризації тощо. А хімічні властивості речовини (здатність вступати у хімічну взаємодію з іншими речовинами) повною мірою належать і кожній окремій молекулі.
| Молекули складаються з атомів, які сполучені між собою хімічними зв’язками у певній послідовності і певним чином орієнтовані у просторі (рис.1.2). Кількість атомів у молекулі коливається від двох (Н2, О2, НСl) до декількох тисяч (вітаміни, гормони, білки). Атоми благородних газів (He, Ne, Ar, Kr, Xe, Rn) іноді називають одноатомними молекулами. Склад молекули – найважливіша характеристика молекули і речовини – описується хімічними формулами. Між молекулами є відстані, що зумовлені агрегатним станом речовини: у газах вони | 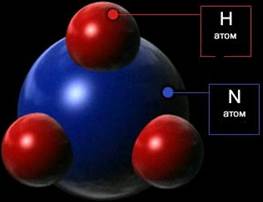 Рисунок 1.2 – Схематична модель молекули NH3
Рисунок 1.2 – Схематична модель молекули NH3
|
складають 10–8–10–7м, у твердих тілах – приблизно 10–10м.
При фізичних явищах молекули зберігаються, а при хімічних перетвореннях – руйнуються, утворюючи нові речовини.
Кількісною характеристикою молекули є відносна молекулярна маса М r.
Відносна молекулярна маса Мr – це відношення середньої маси молекули речовини до 1/12 маси атома Карбону –12.
У системі СІ відносна молекулярна маса Mr – безрозмірна величина, а позасистемною одиницею її вимірювання є а.о.м.
Відносна молекулярна маса Мr дорівнює сумі відносних атомних мас Аr елементів, що входять до складу молекули, з урахуванням кількості атомів кожного елемента, наприклад:
M r (SO2) = A r (S) + 2 A r (O) = 32 + 2·16 = 64а.о.м.×
Абсолютна маса молекули визначається як добуток М r на атомну одиницю маси:
m(молекули SO2) = M r (SO2)·1,66·10–27 = 64·1,66·10–27 = 1,06·10–25кг.
Молекулярну будову мають органічні сполуки і частина неорганічних речовин, але більшість неорганічних речовин складається з йонів, в яких носіями хімічних властивостей є умовні частинки – асоціати йонів. Тому до речовин йонної будови неможливо застосовувати поняття «молекула» так само як і до металів та їх сплавів, кристалічна rратка яких має свої специфічні особливості. Таким чином, з сучасної точки зору молекула – це найменша електронейтральна замкнута сукупність атомів, що утворює певну структуру за допомогою хімічних зв’язків.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 609; Нарушение авторских прав?; Мы поможем в написании вашей работы!