
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основні газові закони
|
|
|
|
II Наслідок закону Авогадро
Відношення густини одного газу до густини іншого газу за однакових умов дорівнює відношенню їх молярних мас М або відносних молекулярних мас Мr.
Ця величина називається відносною густиною одного газу за іншим і позначається буквою d або D:
 (1.6)
(1.6)
Звідки r1 = r2×d2(газу1); r2 = r1/d2(газу1), (1.7)
М(газу1) = d2(1)×M(газу2); M(газу2) = M(газу1)/d2(газу1). (1.8)
Відносна густина d – це величина безрозмірна, вона показує, наскільки один газ важче за інший (рис.1.28).
Стан газу характеризується його об’ємом, тиском і температурою. Між цими величинами експериментально були встановлені такі закони:
- Закон Бойля-Маріотта (ізотермічний) скорочено записується так:
при Т = const Р1·V1 = Р2·V2, або Р·V = const;
- Закон Гей-Люссака (ізобаричний)
при Р = const V1/T1 = V2/T2, або V / T = const.
- Закон Шарля (ізохоричний)
при V = const Р1/T1 = Р2/T2, або Р/T = const.
Усі три закони можна поєднати в один універсальний газовий закон, що описується рівнянням Клапейрона:
 (1.9)
(1.9)
Залежність для одного моля газу була виведена Менделєєвим, тому називається рівнянням Менделєєва-Клапейрона. Воно містить постійну величину – універсальну газову сталу R (табл.1.2):
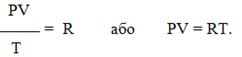
Для довільної кількості газу рівняння Менделєєва-Клапейрона має вигляд:
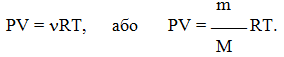 (1.10)
(1.10)
Таблица 1.2 – Розрахунки значень універсальної газової сталої R
| Тиск Р (н.у.) | Темперутура Т, К (н.у.) | Молярний об'єм VМ (н.у.) | Універсальна газова стала R = РV/T |
| 101325Па | 273,15 | 22,4×10–3м3/моль | 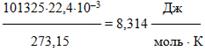
|
| 1атм | 273,15 | 22,4л/моль | 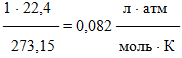
|
| 760мм рт.ст. | 273,15 | 22400мл/моль | 
|
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 616; Нарушение авторских прав?; Мы поможем в написании вашей работы!