
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Хімічний елемент
|
|
|
|
Нині відомо 118 хімічних елементів: з них 89 виявлені у природі, а інші отримані штучно під час ядерних реакцій.
Хімічний елемент – це вид атомів з однаковим зарядом ядра.
Кожний елемент має свою назву і символ. Назви елементів з порядковими номерами 104-109 затверджені радою IUPAC (1997 р.) Пізніше були названі інші елементи. Тепер елемент №104 має такі назву і символ: Резерфордій Rf, №105 – Дубній Db, №106 – Сиборгій Sg, №107 – Борій Bh, елемент №108 – Хассій Hs, №109 – Мейтнерій Mt, №110 – Дармштадтій Ds. Хімічні елементи №№111-118 ще не одержали офіційних назв, тому їх поки що називають за порядковими номерами, наприклад: №111 – Унунуній Uuu (один, один, один); №112 – Унунбій Uub (один, один, два) і т.д.
Хімічний символ означає, по-перше, назву елемента, по-друге, – один атом цього елемента при записах формул хімічних реакцій.
Останнім часом відповідно до Державного стандарту України (ДСТУ 2439-94) українські назви хімічних елементів вживаються як похідні від латинських назв (табл.1.1). Вони записуються з великої літери на відміну від назв простих речовин і атомів, наприклад: Гідроген Н, Карбон С, Оксиген О, Нітроген N – елементи; водень Н2, вуглець С, кисень О2, азот N2 – прості речовини чи атоми.
Таблиця 1.1 – Назви деяких хімічних елементів
| Хімічний символ | Вимова хімічного символа | Українська назва | |
| хімічного елемента | простої речовини чи окремого атома | ||
| Ag | Аргентум | Аргентум | срібло |
| As | Арсенікум | Арсен | арсен, миш’як |
| Au | Аурум | Аурум | золото |
| Ві | Вісмут | Бісмут | бісмут |
| C | Це | Карбон | вуглець |
| Cl | Хлорум | Хлор | хлор |
| Cu | Купрум | Купрум | мідь |
| F | Флуорум | Флуор | фтор |
| Fe | Ферум | Ферум | залізо |
| H | Аш | Гідроген | водень |
| Hg | Гідраргірум | Меркурій | ртуть |
| Mn | Манган | Манган | марганець |
| N | Ен | Нітроген | азот |
| Ni | Нікель | Нікель | нікель |
| O | О | Оксиген | кисень |
| P | Пе | Фосфор | фосфор |
| Pb | Плюмбум | Плюмбум | свинець |
| S | Ес | Сульфур | сірка |
| Sb | Стибіум | Стибій | антимон, сурма |
| Si | Силіціум | Силіцій | кремній |
| Sn | Станум | Станум | оливо, цина |
Носієм властивостей хімічних елементів є атом. Входячи до складу різних речовин, атоми кожного елемента надають їм певних властивостей. Так, речовини NaCl, Na2S, Na2O мають деякі спільні властивості завдяки наявності йона Na+, але також і відмінності за рахунок йонів Cl–, S2–, O2–.
Основною кількісною характеристикою елемента є заряд ядра його атомів Z, що збігається з порядковим номером елемента. У природі відсутні різні хімічні елементи, які мали б однаковий заряд ядра, тому можна однозначно визначити елемент за зарядом ядра його атома. Відносна атомна маса Аr теж деякою мірою може правити кількісною характеристикою елемента, але не вичерпною, оскільки за величиною А r неможливо визначити елемент. Існують атоми різних елементів з однаковими Аr – так звані ізобари, наприклад, 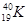 і
і  . З іншого боку, як вже згадувалося, існують атоми одного й того самого елемента з різними Аr – ізотопи, наприклад
. З іншого боку, як вже згадувалося, існують атоми одного й того самого елемента з різними Аr – ізотопи, наприклад 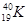 і
і 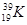 .
.
Формули ізотопів звичайно записують за допомогою символу хімічного елемента, зазначивши заряд ядра (зліва знизу) і масового числа (зліва зверху). Винятком є ізотопи елемента Гідрогену, для яких поряд з традиційною символікою допускаються й індивідуальні назви і позначення (рис. 1.3).
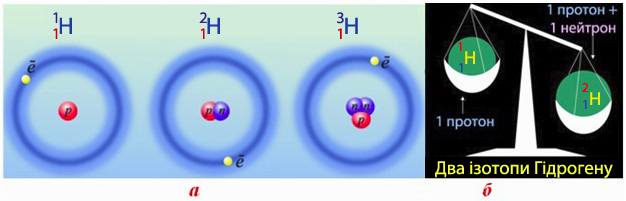
Рисунок 1.3 – Ізотопи елемента Гідрогену: а) моделі Протію 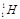 (в ядрі міститься тільки один протон p), Дейтерію
(в ядрі міститься тільки один протон p), Дейтерію 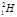 (у ядрі по одному протону p і нейтрону n), Тритію
(у ядрі по одному протону p і нейтрону n), Тритію 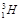 (ядро складається з одного протону p і двох нейтронів n); б) співвідношення атомних мас Протію і Дейтерію
(ядро складається з одного протону p і двох нейтронів n); б) співвідношення атомних мас Протію і Дейтерію
Кожний елемент має декілька ізотопів (природних чи штучних), тому в періодичній системі наводиться середня А r з урахуванням розповсюдженості ізотопів у природі. Так, Хлор має два ізотопи 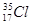 і
і 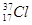 , тому відносна атомна маса елемента Хлору з урахуванням процентного вмісту ізотопів дорівнює
, тому відносна атомна маса елемента Хлору з урахуванням процентного вмісту ізотопів дорівнює
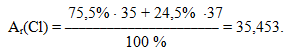
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 1345; Нарушение авторских прав?; Мы поможем в написании вашей работы!