
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон еквівалентів
|
|
|
|
Із закону сталості складу випливає, що елементи сполучаються один із одним у певних кількісних співвідношеннях, для характеристики яких було введено поняття еквівалента і еквівалентної маси (слово еквівалентний у перекладі означає рівноцінний).
Еквівалентом називається умовна чи реальна частинка речовини, яка може приєднувати, заміщати, віддавати або взаємодіяти іншим чином з одним йоном Гідрогену Н+ чи гідроксилу ОН– у кислотно-основних (або йоннообмінних) реакціях чи одному електрону в окисно-відновних реакціях.
Наприклад, еквівалентом нітратної (азотної) кислоти є реальна частинка – молекула HNO3, що містить один Йов Н+; еквівалентом ортофосфатної (фосфорної) кислоти – умовна частинка, що відповідає 1/3 молекулі Н3РО4, до складу якої входять три йони Н+.
Але еквіваленти одного елемента можуть бути різними – залежно від валентності елемента. Так само складна сполука може мати різні еквіваленти, що зумовлюється характером її хімічної взаємодії. Наприклад, в реакції нейтралізації ортофосфатної кислоти калій гідроксидом
H3PO4 + 2KOH à K2HPO4 + 2H2O.
тільки два атоми Н кислоти заміщуються атомами К (тобто кислота виявляє основність 2). Тоді згідно з визначенням, еквівалентом H3PO4 буде умовна частинка, яка складає 1/2H3PO4, оскільки на один атом Н припадає саме половина молекули H3PO4.
Отже, еквівалент – це фактично одна частка молекули, яка відповідає одному атому Н чи йону Н+ (рис.1.18).
Число, що показує, яка частина молекули чи іншої частинки речовини відповідає еквіваленту, називається фактором еквівалентності fЕ.
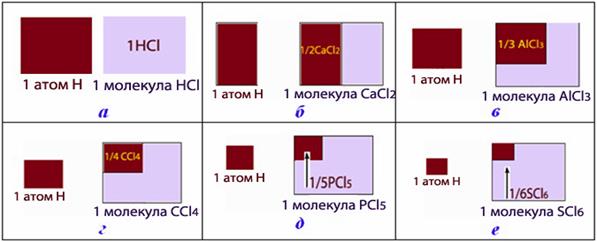
Рисунок 1.18 – Еквівалент і фактор еквівалентності: а) fЕ(HCl) = 1; б) fЕ(CaCl2) = 1/2; в) fЕ(AlCl3) = 1/3; г) fЕ(CCl4) = 1/4; д) fЕ(PCl5) = 1/5; д) fЕ(SCl6) = 1/6. (Еквіваленти сполук забарвлені темним відтінком)
Як частинка еквівалент характеризується кількістю речовини nекв і молярною масою еквівалента mекв, яку частіше для скорочення називають просто еквівалентною масою.
Еквівалентна маса елемента – це маса одного моль еквівалентів, яка дорівнює відношенню молярної маси елемента до його валентності в сполуці (або добутку фактора еквівалентності на молярну масу елемента):
 (1.11)
(1.11)
Або: mекв.елемента = fE·Мелемента. (1.12)
- Еквівалентна маса оксиду дорівнює відношенню його молярної маси М до добутку валентності елемента В на число атомів елемента ч:
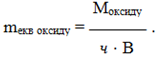 (1.15)
(1.15)
- Еквівалентна маса кислоти дорівнює відношенню її молярної маси М до основності – кількості атомів Н, здатних заміщуватися атомами металу:
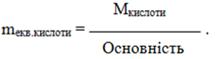 (1.16)
(1.16)
- Еквівалентна маса основи дорівнює відношенню її молярної маси М до кислотності – кількості гідроксильних груп ОН, що заміщуються на кислотний залишок:
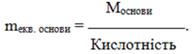 (1.17)
(1.17)
- Еквівалентна маса солі дорівнює відношенню її молярної маси М до добутку валентності В металу на кількість його атомів ч:
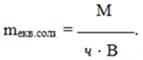 (1.18)
(1.18)
Закон еквівалентів був експериментально встановлений Ріхтером (1797 р.) і остаточно сформульований Дальтоном (1803 р.):
Хімічні сполуки реагують між собою в еквівалентних співвідношеннях.
З цього випливає, що для двох будь-яких речовин однієї хімічної реакції (вихідних реагентів чи продуктів реакції) закон еквівалентів можна виразити так:
nекв1 = nекв2. (1.20)
Підставивши (1.13) і (1.14) в останнє одержимо ще один вираз закону еквівалентів:
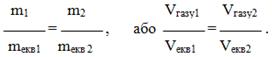 (1.21)
(1.21)
Однак при практичних розрахунках іноді зручніше користуватися іншим формулюванням закону еквівалентів:
маси речовин(об’єми газів), що взаємодіють між собою, пропорційні їх еквівалентним масам (об’ємам газів):
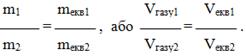
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 2166; Нарушение авторских прав?; Мы поможем в написании вашей работы!