
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
ЗАКОН Авогадро
|
|
|
|
| Одним з найважливіших газових законів є закон Авогадро (рис.1.15): У рівних об’ємах різних газів за однакових умов міститься однакова кількість молекул: N = const, якщо Р,V,T = const, |  Рисунок 1.15 – Закон Авогадро
Рисунок 1.15 – Закон Авогадро
|
де N – кількість молекул, Р – тиск, V – об’єм, T – температура.
Але оскільки число молекул у реальних зразках речовини дуже велике, то було введено універсальну кількісну характеристику, що описує чисельний стан речовин.
Кількість речовини n (або n ) – це фізична величина, що визначається числом частинок – структурних елементів речовини: молекул, атомів, йонів, йонних асоціатів тощо.
Одиницею її вимірювання є [ моль ] – одна з основних одиниць системи CI.
Моль – це кількість речовини, що містить стільки ж структурних елементів речовини, скільки атомів міститься в ізотопі Карбону-12 масою 12·10 – 3 кг.
Встановлено, що маса одного атома ізотопу Карбону-12 складає 19,92·10–27кг. Тоді число атомів N в 12·10-3кг дорівнює
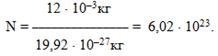
Число, що дорівнює 6,02 · 1023 мол – 1 називається сталою Авогадро.
Стала Авогадро позначається NA і вказує на число частинок – структурних елементів речовині, кількість якої становить 1моль і тому має розмірність моль–1.
Отже, моль будь-яких структурних елементів – це така кількість речовини, що містить 6,02·1023 частинок. Наприклад, 1моль Н2О складається з 6,02·1023 молекул і містить 2моль (або 2·6,02·1023) атомів Н і 1моль (або 6,02·1023) атомів О; 1моль SO42– містить 6,02·1023 йонів в SO42–, у тому числі 1моль (6,02·1023) атомів S і 4моль (4·6,02·1023) атомів О.
Кількість речовини пов’язана з числом частинок N і сталою Авогадро NA залежністю:
n = N / NA. (1.1)
Маса одного моля речовини називається молярною масою цієї речовини (рис.1.16), вона позначається через М.
Молярна маса – це фізична величина, що визначається відношенням маси речовини до кількості речовини, яка їй відповідає: М = m/n.
Одиницею вимірювання молярної маси в системі СІ є [кг/моль], але в хімії частіше користуються позасистемною величиною [г/моль], або [г×моль–1].

Рисунок 1.16 – Молярна маса речовини: а) М(атомів) – це маса одного моль (6,02·1023) атомів; б) М(молекул) – це маса одного моль (6,02·1023) молекул
Молярна маса М пов’язана з відносною молекулярною масою M r і сталою Авогадро NA залежністю
М = М r ×NA×1а.о.м. (1.2)
Наприклад, відносна молекулярна маса карбон (ІV) оксиду дорівнює
Мr(CO2)=12+2×16=44,
а атомна одиниця маси складає 1а.о.м.=1,66×10–24г, тоді молярна маса буде
М(СО2)=44×6,02·1023·1,66·10–24=44г/моль.
Тобто молярна маса чисельно дорівнює відносній молекулярній масі, але має зовсім інший фізичний зміст: Мr характеризує масу однієї молекули, а М – масу одного моля, тобто 6,02·1023 молекул.
Закону Авогадро підлягають усі гази незалежно від розмірів їх молекул. Не підлягають йому гази за умов низьких температур та високого тиску, а також речовини в рідкому або твердому стані. Це пояснюється так. Як відомо, об’єм, що займає певна кількість речовини, обумовлюється трьома параметрами: числом складових частинок, відстанями між ними та їх розмірами. У газах за умов високих температур і низького тиску відстані між молекулами в тисячі разів більші за їх розміри, тому розмірами молекул можна знехтувати. Внаслідок цього об’єм газу буде обумовлюватися вже тільки двома параметрами: числом молекул і відстанями між ними. Але за однакових умов (тиск і температура) відстані між молекулами в різних газах однакові, тому в цьому випадку рівні об’єми різних газів містять одне й те саме число молекул.
За низьких температур та під високим тиском відстані між молекулами в газах зменшуються і стають сумірними з розмірами самих молекул, тому об’єм газу залежить також від розмірів молекул, а гази перестають підлягати закону Авогадро.
Дуже часто необхідно буває необхідним знати молярна маса повітря, яка обчислюється як і молярна маса будь-якої суміші газів з урахуванням об’ємної частки j кожного газу:
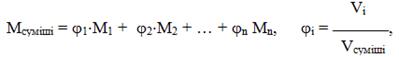 (1.3)
(1.3)
Об’ємні частки кисню і азоту в повітрі приблизно складають j(О2)×≈ 0,2 (або 20%), j(N2) ≈ 0,8 (або 80%). Тода молярна маса повітря:
Мповітря = j(О2)×М(О2) + j(N2)×М(N2) = 0,2×32 + 0,8×28 = 29г/моль.
I Наслідок закона Авогадро:
Один моль будь-якого газа зо нормальних умовх (н.у.) займає об’єм приблизно 22,4 л (0,0224 м3).
Ця величина називається молярним об’ємом, позначається VM і вимірюється у [л/моль] або [м3/моль] (рис.1.17).
Нормальними умовами вважаються:
Р = 101325Па (~105Па) = 1атм =
= 760мм рт.ст.,
Т= 273,15К, або t = 00С.
Молярний об’єм – це емпірично встановлена величина на основі співвідношень:
 (1.4)
де r – густина газу, [г/л], або [кг/м3]. (1.4)
де r – густина газу, [г/л], або [кг/м3].
|  Рисунок 1.17 – Молярний oб’єм газів:
за н.у. VM = 22,4л/моль
Рисунок 1.17 – Молярний oб’єм газів:
за н.у. VM = 22,4л/моль
|
Молярний об’єм на відміну від молярної маси не є постійною величиною, а залежить від умов (Р, Т), тому VM як поняття вживають звичайно для газів за н.у.
Молярний об’єм пов’язаний з іншими величинами (об’ємом V, кількістю речовини n, молярною масою М, густиною r, числом Авогадро NA і кількістю частинок N) співвідношеннями:
 (1.5)
(1.5)
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 796; Нарушение авторских прав?; Мы поможем в написании вашей работы!