
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теоретичні відомості. Електрохімічна система, в якій за рахунок хімічних реакцій здійснюється електрична робота, називається гальванічним (електрохімічним) елементом
|
|
|
|
Електрохімічна система, в якій за рахунок хімічних реакцій здійснюється електрична робота, називається гальванічним (електрохімічним) елементом. Загальну схему гальванічного елемента можна представити таким чином:
М | метал1| розчин1 || розчин 2| метал 2 | М.
Межі поділу фаз в схемі позначаються вертикальними лініями, М – металічний дріт (звичайно в схемі елемента позначення дроту випускають).
Якщо на обох кінцях елемента міститься один провідник (М), елемент називають правильно розімкнутим. Різниця потенціалів на кінцях правильно розімкнутого елемента є його електрорушійною силою (ЕРС). ЕРС гальванічного елемента дорівнює сумі стрибків потенціалів на межах поділу фаз:
E = φ1 + φ2 + φд + φк,
де j1 і j2 – електродні потенціали, jд – дифузійний потенціал, jк – контактний потенціал.
Механізм виникнення електродного потенціалу пов’язаний із виникненням подвійного електричного шару, якщо занурити металеву пластинку в розчин власної солі, то можливі два протилежні процеси:
а) перехід йонів металу із пластинки в розчин під дією диполів води:
 .
.
б) осадження йонів Men+ на пластинці:
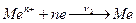 .
.
У розведених розчинах швидкість переходу йонів з активного металу в розчин більша, ніж швидкість зворотного процесу, яка можлива при високих концентраціях Men+.
При цьому зменшується кількість позитивно заряджених йонів на металі, які перейдуть в розчин, а на металі буде негативний заряд, і чим більша буде різниця v 1 – v 2, тим негативнішим буде заряд електроду.
Рівноважний стан різниці потенціалів на межі поділу фаз метал–розчин називають електродним потенціалом. Він обмежує процес подальшого переміщення йонів з металу або на метал, у зв'язку з чим кожному металу і певній концентрації його солі відповідає той чи інший потенціал. Величина електродного потенціалу залежить від природи металу та активності його йонів у розчині і її розраховують за формулою:

де R – універсальна газова стала; Т – температура, за якої відбувається реакція; n – кількість електронів, що втрачає атом металу; F – стала Фарадея; а(Меn+) – активність йонів металу в розчині, j0 – стандартний електродний потенціал.
Вище приведене рівняння – називають рівнянням Нернста (1890 р.). Якщо в нього підставити значення сталих величин (R = 8,314 Дж/моль∙К; F = 9,65∙104 Кл/моль), то для досить розбавлених розчинів за температури 298 К матимемо:

Тепер визначимо фізичну суть величини (j0) у рівнянні електродного потенціалу Нернста. Якщо за стандартних умов активність йонів металу в розчині дорівнює 1 кмоль/м3, то lg а (Меn+) = lg1 = 0, тоді j = j0. Отже, j0 – це електродний потенціал, який виникає при зануренні металевої пластинки в розчин, в якому активність йонів металу дорівнює 1 кмоль/м3. Ця величина одержала назву стандартного (або нормального) електродного потенціалу.
Стрибок потенціалу на межі поділу метал–розчин, як і різницю потенціалів між двома точками, які перебувають у різних фазах, експериментально виміряти неможливо. Дослідним шляхом вимірюють лише ЕРС кола, що складається з досліджуваного та стандартного електро 
 да, потенціал якого умовно приймають рівним нулю. Таким електродом за міжнародною угодою є стандартний водневий електрод.
да, потенціал якого умовно приймають рівним нулю. Таким електродом за міжнародною угодою є стандартний водневий електрод.
Стандартний водневий електрод – це платинова пластинка, яка занурена в розчин сульфатної кислоти з активністю йонів Н3О+, рівною, за температури 298 К, 1 моль/л. Платинову пластинку, покриту губчастою платиною, насичують воднем під тиском 101,3 кПа.
Електродні потенціали усіх електродів, виміряні відносно стандартного водневого електрода, складають ряд стандартних електродних потенціалів.
За величиною електродного потенціалу можна встановити напрямок перебігу електродної реакції. Будь-який електрод, розміщений вище в ряді стандартних електродних потенціалів, знаходиться в більш окисленому стані, ніж розміщений нижче. Якщо з двох таких електродів скласти гальванічний елемент, то на першому буде відбуватися реакція окиснення, на другому – відновлення.
Кількісна залежність між величиною потенціалу, співвідношенням концентрацій окисненої і відновленої форми і температурою виражається рівнянням Нернста-Петерса:
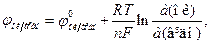
де а (ок) і а (відн) – відповідно активності окисненої та відновленої форм, n – кількість електронів, що беруть участь в електродному процесі.
Прийнята така класифікація електродів. Електроди першого роду, оборотні по катіону, потенціал яких обчислюють за рівнянням Нернста. До електродів першого роду відносять:
а) металічні електроди, наприклад, срібний Ag+ | Ag;
б) амальгамні металічні електроди, наприклад, кадмієвий Cd2+ | Cd;
в) газові електроди, наприклад, водневий H+ | Pt, Н2.
Електроди II роду складаються із металу, покритого його важкорозчинною сполукою (сіллю, оксидом, гідроксидом) і зануреного в розчин добре розчинної сполуки з тим же аніоном. Можна навести такі приклади електродів другого роду:
а) хлорсрібний електрод Ag, AgCl | Сl–;
б) каломелевий електрод Hg, Hg2Cl2 | Сl–.
Електроди третього роду менш поширені. Вони складаються з металу який контактує з двома важкорозчинними сполуками, що мають спільний аніон.
Окисно-відновні являють собою інертний метал занурений в розчин, що містить окислену і відновлену форми. Розрізняють прості і складні окисно-відновні електроди:
а) прості окисно-відновні електроди: Pt | Fe2+, Fe3+;
б) складні окисно-відновні електроди хінгідронний електрод: Pt | С6Н4О2, С6Н4(ОН)2, H+.
Йонселективні електроди (ЙСЕ) – це електроди в електродній реакції яких електрони участі не беруть, а їх потенціали визначаються процесами розподілу йонів між мембраною і розчином. Такі електроди дають змогу селективно визначати який-небудь йон в присутності інших йонів, їх називають йонселективними електродами (ЙСЕ). Першим представником ЙСЕ був електрод зі скляною мембраною – скляний електрод. Нині створені ЙСЕ на основі рідких та твердих іонітів, моно- і полікристалів, елементоорганічних сполук, мембраноактивних комплексонів. Широко застосовуються електроди, селективні до йонів К+, Na+, Тl+, NН4+, Са2+, Ва2+, Сd2+, Сu2+, Аg+, F–, Сl–, Вr–, І–, NО2–, СN–, ВF4–, SCN–, СlO4–, СО32–. Створені рідинні електроди для органічних йонів, ферментні та субстратні, а також газочутливі.
Схему селективного електрода можна записати у вигляді:

ЙСЕ
Мембрана розділяє два розчини (досліджуваний та стандартний), які містять йони, здатні проникати в мембрану і рухатися в ній. Стандартний розчин містить тільки один вид мембраноактивних йонів – А+. Склад стандартного розчину залишається незмінним. Досліджуваний розчин містить йони А+ і В+, склад його змінюється. Для потенціалу А+ селективного електрода Нікольський отримав рівняння:
jЙСЕ = const + θlg (a A+ + KА–В ∙ а В+),
де θ = 2,303RT/F, при Т = 298 К, θ = 0,059.
Це рівняння було виведене без урахування дифузійного потенціалу, який виникає в мембрані внаслідок різної рухливості йонів А+ і В+. В результаті врахування дифузійного потенціалу рівняння було перетворене:
jЙСЕ = const + θlg (a A+ + KА/В ∙ а В+).
За формою останні рівняння однакові. Але константа KА/В має більш складний зміст, ніж KА–В тому що містить множник, який ураховує роль відносних рухливостей йонів.
Одержане рівняння – основне рівняння теорії ЙСЕ, а величина KА/В – основна характеристика властивостей ЙСЕ. З одного боку, вона зв'язана з відносною рухливістю йонів в мембрані: чим більша рухливість заважаючого йона В+, тим більший його вплив на потенціал А+-селективного електрода. З другого боку, KА/В залежить від селективності поглинання мембраною йона при йонному обміні. Величину KА/В називають коефіцієнтом селективності ЙСЕ, або коефіцієнтом впливу йонів В+ на А+-функцію електрода.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 594; Нарушение авторских прав?; Мы поможем в написании вашей работы!