
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розподіли Больцмана, Максвела-Больцмана,їх аналіз
|
|
|
|
Барометрична формула дає можливість також визначити залежність концентрації газу від висоти. З рівняння стану ідеального газу у вигляді P=nkT при Т=const отримуємо 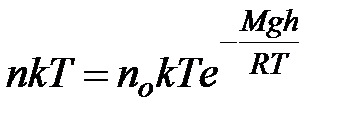 , де no – концентрація молекул на висоті h = 0.
, де no – концентрація молекул на висоті h = 0.
Оскільки M = moNA, R = k moNA, то  , де Wn = mogh – потенціальна енергія молекули у полі тяжіння. Із збільшенням висоти концентрація молекул зменшується за експоненціальним законом. При зменшенні температури Т ®0 концентрація n ®0, тобто всі молекули опускаються на дно посудини. Больцман довів, що це співвідношення вірне не тільки для поля тяжіння, але і для інших потенціальних полів, якщо маси молекул однакові і вони знаходяться у стані теплового хаотичного руху. Тому цей вираз
, де Wn = mogh – потенціальна енергія молекули у полі тяжіння. Із збільшенням висоти концентрація молекул зменшується за експоненціальним законом. При зменшенні температури Т ®0 концентрація n ®0, тобто всі молекули опускаються на дно посудини. Больцман довів, що це співвідношення вірне не тільки для поля тяжіння, але і для інших потенціальних полів, якщо маси молекул однакові і вони знаходяться у стані теплового хаотичного руху. Тому цей вираз
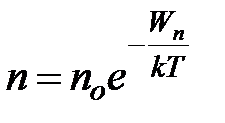
називається розподілом Больцмана для частинок у зовнішньому потенціальному полі.
23.Основні поняття термодинаміки: Термодинамічна система (ТДС) – це фізична система, що складається з великої кількості мікрочастинок, які беруть участь у тепловому русі, взаємодіють між собою та з навколишнім середовищем, обмінюючись, зокрема, енергією. Термодинамічний процес – це процес переходу системи з одного початкового стану в інший через послідовність проміжних станів. Важливою характеристикою стану термодинамічної системи є її внутрішня енергія U – це кінетична енергія хаотичного теплового руху мікрочастинок і потенціальна енергія їх взаємодії. Внутрішня енергія – однозначна функція стану термодинамічної системи, тобто у кожному стані, який характеризується параметрами P, V, T, система має цілком визначене значення внутрішньої енергії U. Початком відліку внутрішньої енергії звичайно вважають стан при T = 0 К. Хоча при переході з одного стану в інший практичний інтерес має тільки зміна внутрішньої енергії DU, тому вибір початку відліку не має особливого значення. В ідеальному газі не враховуються сили взаємодії між молекулами, а отже, потенціальна енергія молекул дорівнює нулю. Тому внутрішня енергія ідеального газу дорівнює сумарній кінетичній енергії їх теплового руху: U = < e o> N =  =
= 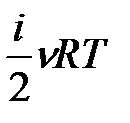 =
= 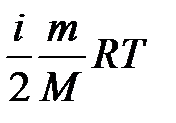 . Тут ураховано, що kNA=R, n=m/M. Внутрішня енергія ідеального газу залежить від виду газу і його абсолютної температури. Робота – це форма передавання енергії при силовій взаємодії. Друга форма передавання енергії здійснюється при безпосередньому обміні енергіями між молекулами взаємодіючих тіл, тобто у процесі теплообміну. Таку форму передавання енергії у термодинаміці називають теплотою. Теплообмін відбувається у випадку різниці температури взаємодіючих тіл. Унаслідок теплообміну температури тіл вирівнюються. Робота і теплота мають ту спільну властивість, що вони є характеристикою процесу передавання енергії, а їх числові значення істотно залежать від виду процесу. Проте між роботою і теплотою існує глибока якісна відмінність. Виконання роботи над системою може змінити будь-який вид її енергії – механічної або внутрішньої. Теплота може змінити тільки внутрішню енергію системи.
. Тут ураховано, що kNA=R, n=m/M. Внутрішня енергія ідеального газу залежить від виду газу і його абсолютної температури. Робота – це форма передавання енергії при силовій взаємодії. Друга форма передавання енергії здійснюється при безпосередньому обміні енергіями між молекулами взаємодіючих тіл, тобто у процесі теплообміну. Таку форму передавання енергії у термодинаміці називають теплотою. Теплообмін відбувається у випадку різниці температури взаємодіючих тіл. Унаслідок теплообміну температури тіл вирівнюються. Робота і теплота мають ту спільну властивість, що вони є характеристикою процесу передавання енергії, а їх числові значення істотно залежать від виду процесу. Проте між роботою і теплотою існує глибока якісна відмінність. Виконання роботи над системою може змінити будь-який вид її енергії – механічної або внутрішньої. Теплота може змінити тільки внутрішню енергію системи.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 457; Нарушение авторских прав?; Мы поможем в написании вашей работы!