
- Р Р‡.МессенРТвЂВВВВВВВВжер
- ВКонтакте
- РћРТвЂВВВВВВВВнокласснРСвЂВВВВВВВВРєРСвЂВВВВВВВВ
- РњРѕР№ Р В Р’В Р РЋРЎв„ўР В Р’В Р РЋРІР‚ВВВВВВВВРЎР‚
- LiveJournal
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Адіабатний процес.Рівняння Пуассона
|
|
|
|
Адіабатним процесом називається такий процес, який відбувається без теплообміну термодинамічної системи з навколишнім середовищем (Q12 = 0). Розглянемо адіабатний процес: (1) ® (2), Q12 = 0, Р1, V1, Т1® V2, Р2, Т2. Перший закон термодинаміки для адіабатного процесу має вигляд:
| 0 V 3 V 1 V 2 V Рис. 2.18 |
| P ~ V-g 1 ~ V- 1 |
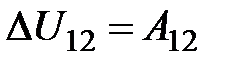 , або
, або 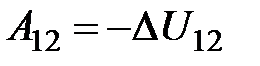 . Тобто в адіабатному процесі робота виконується газом за рахунок зміни його внутрішньої енергії: якщо газ адіабатно розширюється, його робота додатна A 12>0, внутрішня енергія зменшується D U12 <0 і газ охолоджується Т2 < Т1, якщо ж газ адіабатно стискається A 13<0 (
. Тобто в адіабатному процесі робота виконується газом за рахунок зміни його внутрішньої енергії: якщо газ адіабатно розширюється, його робота додатна A 12>0, внутрішня енергія зменшується D U12 <0 і газ охолоджується Т2 < Т1, якщо ж газ адіабатно стискається A 13<0 (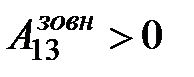 ), його внутрішня енергія і температура зростають D U13 >0, Т3 > Т1 (рис. 2.18). Робота газу в адіабатному процесі знаходиться з виразу:
), його внутрішня енергія і температура зростають D U13 >0, Т3 > Т1 (рис. 2.18). Робота газу в адіабатному процесі знаходиться з виразу: 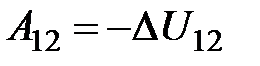 = –nСVDT =
= –nСVDT = 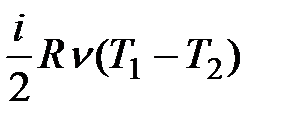 . Теплоємність в адіабатному процесі: CQ= Cт ï Q= 0 =
. Теплоємність в адіабатному процесі: CQ= Cт ï Q= 0 =  . Рівняння адіабатного процесу: PVg = const, або
. Рівняння адіабатного процесу: PVg = const, або 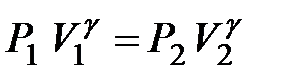 . Цей вираз називають рівнянням Пуассона. Тут
. Цей вираз називають рівнянням Пуассона. Тут 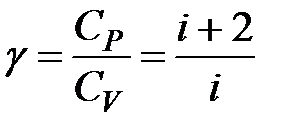 – показник адіабати, або
– показник адіабати, або коефіцієнт Пуассона, який залежить від виду газу. Оскільки g>1, то крива залежності P (V)~ V -g у випадку адіабатного процесуспадає крутіше, ніж у випадку ізотермічного процесу P (V)~ V -1 (рис. 2.18). Інший вигляд рівняння адіабати можна отримати, використавши рівняння Менделєєва–Клапейрона й виразивши з нього тиск через об’єм і температуру або об’єм через тиск і температуру:
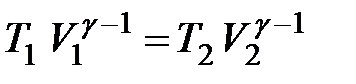 або
або 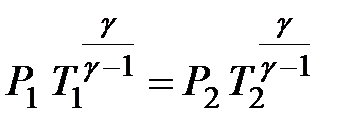 .
.
33.Оборотні і необоротні цикли.Прямі і зворотні цикли
| 0 V 1 V 2 V Рис. 2.19 |
| P Q 1 1 а b ~ Vg Q 2 2 |
| А121 >0 |
На діаграмі (рис. 2.19) зображений цикл, у якому спочатку на ділянці (1)®(а)®(2) газу надається кількість теплоти Q12 = Q1, газ розширюється і виконує додатну роботу А12. Потім зовнішні сили стискають газ на ділянці (2)®(b)®(1), виконуючи роботу 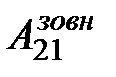 , і від газу забирається кількість теплоти Q21 = –Q2. Робота газу на цій ділянці від’ємна
, і від газу забирається кількість теплоти Q21 = –Q2. Робота газу на цій ділянці від’ємна 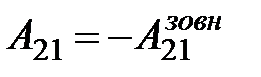 , причому
, причому 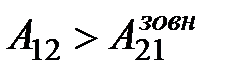 . Такий цикл, який виконується за годинниковою стрілкою, називається прямим циклом. Сумарна робота газу в даному циклі додатна А121 = А12 + А21 > 0 й дорівнює площі заштрихованої фігури.
. Такий цикл, який виконується за годинниковою стрілкою, називається прямим циклом. Сумарна робота газу в даному циклі додатна А121 = А12 + А21 > 0 й дорівнює площі заштрихованої фігури.
| 0 V 1 V 2 V Рис. 2.20 |
| P 1 a b ~ Vg |
| А121 <0 |
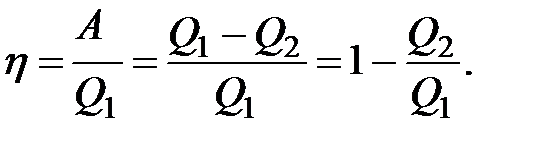 Важливим поняттям у термодинаміці є поняття оборотного термодинамічного процесу. Термодинамічний процес називається оборотним, якщо він може проходити як у прямому напрямку, так й у зворотному через ті самі проміжні стани, без змін в навколишньому середовищі. Необоротним називається процес, коли зворотний перехід через ті самі проміжні стани неможливий. Оборотні процеси – це ідеалізація реальних процесів. Усі реальні процеси є необоротними.
Важливим поняттям у термодинаміці є поняття оборотного термодинамічного процесу. Термодинамічний процес називається оборотним, якщо він може проходити як у прямому напрямку, так й у зворотному через ті самі проміжні стани, без змін в навколишньому середовищі. Необоротним називається процес, коли зворотний перехід через ті самі проміжні стани неможливий. Оборотні процеси – це ідеалізація реальних процесів. Усі реальні процеси є необоротними.|
|
|
Дата добавления: 2015-05-23; Просмотров: 12568; Нарушение авторских прав?; Мы поможем в написании вашей работы!