
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ентропія системи.Статистичне тлумачення 2 закону термодинаміки
|
|
|
|
Якщо внутрішня енергія газу є функцією його термодинамічного стану, тобто визначається параметрами стану P, V, T, то теплота є характеристикою процесу теплообміну і залежить від характеру процесу. Розглянемо тепер зведену кількість теплоти 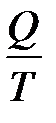 і введемо поняття функції стану, яку визначимо як
і введемо поняття функції стану, яку визначимо як 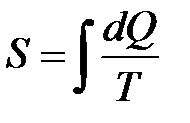 . Ця функція стану, диференціал якої
. Ця функція стану, диференціал якої 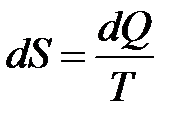 , називається ентропією S. Основною властивістю цієї функції є те, що для будь-якого колового оборотного процесу її зміна дорівнює нулю:
, називається ентропією S. Основною властивістю цієї функції є те, що для будь-якого колового оборотного процесу її зміна дорівнює нулю: 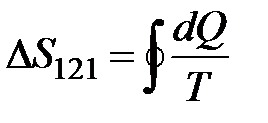 = 0. Ентропія визначається з точністю до постійного доданка і, подібно до потенціальної енергії, фізичний зміст має тільки зміна ентропії для даного процесу (1)®(2):
= 0. Ентропія визначається з точністю до постійного доданка і, подібно до потенціальної енергії, фізичний зміст має тільки зміна ентропії для даного процесу (1)®(2): 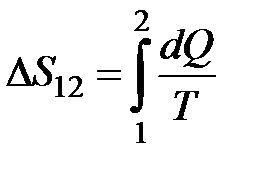 . Кожному стану тіла відповідає одне визначене значення ентропії. Тому ентропія є однозначною функцією стану, яка характеризує напрямок перебігу самодовільних процесів у замкненій термодинамічній системі. Для довільної замкненої системи виконується нерівність Клаузіуса: DS ³0, тобто ентропія замкненої системи або зростає (для необоротних процесів) або залишається постійною (для оборотних процесів). Оскільки всі реальні процеси необоротні, то всі процеси у замкненій системі ведуть до збільшення її ентропії – у цьому полягає принцип зростання ентропії, який лежить в основі формулювання другого закону термодинаміки: в макроскопічній термодинамічній системі можливі лише такі процеси, які ведуть до збільшення ентропії.
. Кожному стану тіла відповідає одне визначене значення ентропії. Тому ентропія є однозначною функцією стану, яка характеризує напрямок перебігу самодовільних процесів у замкненій термодинамічній системі. Для довільної замкненої системи виконується нерівність Клаузіуса: DS ³0, тобто ентропія замкненої системи або зростає (для необоротних процесів) або залишається постійною (для оборотних процесів). Оскільки всі реальні процеси необоротні, то всі процеси у замкненій системі ведуть до збільшення її ентропії – у цьому полягає принцип зростання ентропії, який лежить в основі формулювання другого закону термодинаміки: в макроскопічній термодинамічній системі можливі лише такі процеси, які ведуть до збільшення ентропії.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 761; Нарушение авторских прав?; Мы поможем в написании вашей работы!