
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ізотерми Ван-дер-Вальса.Порівняння зексперементальними ізотермами
|
|
|
|
З рівняння Менделєєва–Клапейрона виходить, що при Т = const і m = const залишається постійним добуток PV = const, тобто це ізотермічний закон Бойля-Маріотта, звідки P=const/V. З рівняння Ван-дер-Ваальса випливає більш складна залежність P = f(V) при постійній температурі:  . Отримане рівняння є алгебраїчним рівнянням третього степеня відносно молярного об’єму. Існує критична температура Т к: при T>Т к ізотерми реального газу майже не відрізняються від ізотерм ідеального газу, при T<Т к є область станів, де ізотерма має хвилеподібну ділянку і кожному значенню тиску відповідають три точки ізотерми. При підвищенні температури ці точки зближуються і при T=Т к зливаються в одну точку К, яка є точкою перегину ізотерми при T=Т к. При підвищенні температури до критичної Т = Т к отримуємо критичну ізотерму без хвилеподібних ділянок. При цій температурі зникає різниця між газоподібним і рідким станом речовини. Відповідні тиск Р к і молярний об’єм Vm к також називаються критичними, а стан з критичними параметрами речовини Р к, Vm к, Т к називається критичним станом. Критичні параметри Р к, Vm к, Т к можна знайти з рівняння Ван-дер-Ваальса через сталі a i b:
. Отримане рівняння є алгебраїчним рівнянням третього степеня відносно молярного об’єму. Існує критична температура Т к: при T>Т к ізотерми реального газу майже не відрізняються від ізотерм ідеального газу, при T<Т к є область станів, де ізотерма має хвилеподібну ділянку і кожному значенню тиску відповідають три точки ізотерми. При підвищенні температури ці точки зближуються і при T=Т к зливаються в одну точку К, яка є точкою перегину ізотерми при T=Т к. При підвищенні температури до критичної Т = Т к отримуємо критичну ізотерму без хвилеподібних ділянок. При цій температурі зникає різниця між газоподібним і рідким станом речовини. Відповідні тиск Р к і молярний об’єм Vm к також називаються критичними, а стан з критичними параметрами речовини Р к, Vm к, Т к називається критичним станом. Критичні параметри Р к, Vm к, Т к можна знайти з рівняння Ван-дер-Ваальса через сталі a i b:
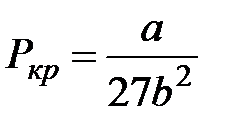 ,
,  ,
,  .
.
Пара відрізняється від інших газоподібних станів тим, що при ізотермічному стисканні відбувається процес зрідження. А газ, який знаходиться при температурі вищій за критичну T>Т к, не може бути перетворений стисканням на рідину.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 572; Нарушение авторских прав?; Мы поможем в написании вашей работы!