
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Параметри системи при змішуванні розчинів
|
|
|
|
| Параметри | Частини системи | ||
| Розчин І | Розчин ІІ | Розчин ІІІ | |
| Число молей речовини | 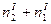
| 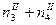
|  ; ;
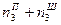 ; ;
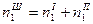
|
| Число молей води, яка зв’язана з компонентами |  ; ;
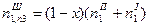
| ||
| Співвідношення молей речовини і води | 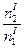
| 
| 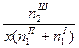 ; ;

|
| Ентальпія розчинення на 1моль розчинених речовин | 
| 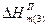
|  ; ;

|
х – умовна доля води, яка залежить від співвідношення  .
.
Теплота кристалізації Qк дорівнює залишковій диференціальній теплоті розчинення L, але оборотна їй за знаком. Теплоту кристалізації (в кДж/моль) можна розраховувати користуючись номограмою (рис.2.6). Наприклад, маючи дані про розчинність речовини при двох температурах, з'єднують на монограмі значення концентрації і температури прямими лініями. Нехай розчинність першої речовини при 20° С дорівнює 20%, а другої при температурі 60° С – 50 %.
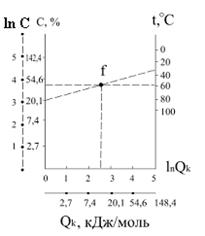
|
| Рис.2.6. Номограма для знаходження теплоти кристалізації (Qk) |
На лівій ординаті відмічаємо точку lnC1 = ln20 =3,86 і з'єднуємо її з точкою t1 = 30° C на правій ординаті. Потім точку lnC2 ln50 = 5,28 з'єднуємо з точкою t2 = 60°C. З фігуративної точки f перетину цих двох прямих опускаємо перпендикуляр на вісь абсцис і визначаємо значення ln Qk, яке дорівнює 2,6. Звідси Qk = 13,4 кДж /моль.
Значення теплот кристалізації, які знаходять за номограмою або розраховують теоретично не є точними, тому більш надійною величиною є теплота розчинення, що визначається експериментально.
Знак величини теплоти кристалізації речовин залежить від їх розчинності. Якщо для речовини температурний коефіцієнт розчинності:
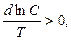
то теплоту кристалізації необхідно відводити, а якщо
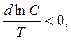
то для проведення процесу кристалізації необхідно підводити тепло.
Теплота кристалізації кристалогідратів зростає зі зростанням кількості молекул води, що входять в склад кристалогідратів. При цьому екзотермічність перших молекул води кристалогідратів значно вище наступних молекул, внаслідок їх більш міцного утримання зі сполукою.
Теплота розчинення, яку визначають експериментально, в загальному випадку складається із декількох складових:
ΔНm =bDН ± +(1-b)DННЕДИС.+DНРОЗП.+DНРЕШ., (2.15)
де β - степінь дисоціації при концентрації Сm; ΔН± - сумарна теплота сольватації (гідратації) катіона і аніона; ΔННЕДИС. - теплота утворення недисоційованної частини їз йонів речовини, що умовно знаходяться в газоподібному стані, і розчинника; ΔНРОЗП. - теплота розподілення розчиненої речовини по об'єму розчину; ΔНРЕШ. - теплота руйнування кристалічної решітки сполуки, що розчиняється.
Ймовірно, що ΔНРЕШ. характерна тільки для конденсованих твердих речовин. Перші три складових рівняння характеризують сольваційно-дисоційні теплові ефекти, до яких можуть бути добавлені теплоти інших фізико-хімічних взаємодій.
Насичені і пересичені розчини. Насичений розчин характеризується стійкою рівновагою розчину з надлишком розчиненої речовини при даній температурі. Стан насичення розчину встановлюється при рівності:
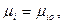
де mі, mіо - хімічні потенціали йонної речовини, що перебуває відповідно в фазі, яка розчиняється, і в насиченому розчині.
Отже, насиченим розчином називається розчин, що містить максимальну кількість речовини, яка може розчинитися в даній кількості розчинника за даної температури. Розчини, що містять більшу або меншу кількість розчиненої речовини називаються відповідно пересиченими і ненасиченими.
Утворення пересиченого розчину можливе під час повільного охолодження розчину, в якому є утруднення з виникненням зародків нової фази (центрів кристалізації), і система переходить в метастабільний стан – пересичений розчин. Цей перехід відповідає потенціалу переносу маси Dm речовини, що розчиняється в насичений розчин, який можна виразити як:
 (2.16)
(2.16)
Стан пересичення бінарних розчинів можна проілюструвати рис.2.7, на якому видно розташування областей ненасиченого (І),

|
| Рис.2.7. Діаграма політерм розчинності і пересичення |
пересиченого метастабільного (ІІ) і лабільного (ІІІ) розчинів, ліній 1,1’, які відповідають концентраціям насичених розчинів, ліній 2,2’ – ліній розділення метастабільного і лабільного пересичених станів. На рисунку 2.7 виділені політерми підвищення розчинності і зниження розчинності (точки з індексами „штрих”) з підвищенням температури.
Шляхом ізотермічного випаровування частини розчинника (лінія NK) в системі утворюється пересичення:
∆CВИП. = СK – СN.
Охолодженням насиченого розчину (точка N,CN) від температури  до
до  (лінія процесу NL) утворюється пересичення
(лінія процесу NL) утворюється пересичення
∆CОХ. = СN - СL.
У випадку зниження розчинності з підвищенням температури (політерма 1ˈ) шляхом випаровування розчинника із розчину, насиченого при температурі  , утворюється пересичення
, утворюється пересичення

Нагрівання насиченого розчину від  до
до  обумовлює створення пересичення
обумовлює створення пересичення
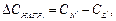
тобто стан пересичення розчинів можна характеризувати температурними перепадами ∆Т, які відповідають собою переохолодженню або перегріву системи.
Явище пересичення можливе і під час хімічної взаємодії, що відбувається між компонентами насиченого розчину. Наприклад, в насиченому розчині СаСО3 (5 мг/дм3) йони Са2+ можуть зв'язуватись йонами 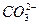 у важкорозчинну сполуку СаСО3 (
у важкорозчинну сполуку СаСО3 (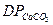 = 4,84 . 10-9) з утворенням пересиченого розчину (200 - 300 мг/дм3 СаСО3).
= 4,84 . 10-9) з утворенням пересиченого розчину (200 - 300 мг/дм3 СаСО3).
Пересичена система, що знаходиться в ізотермічних умовах і ізольована від впливу фізичних і хімічних факторів, тривалий час може бути досить стійкою. В неї важкорозчинна сполука AmBn, що дисоціює за реакцією:
AmBn L mAn+ + nBm-,
для якої
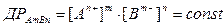
і йонний добуток 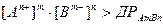 за певних умов випадатиме в осад, доки йонний добуток не буде дорівнювати
за певних умов випадатиме в осад, доки йонний добуток не буде дорівнювати 
В насиченому розчині, в якому  навпаки при введенні в розчин сполука розчинятиметься до настання вищезгаданої рівноваги.
навпаки при введенні в розчин сполука розчинятиметься до настання вищезгаданої рівноваги.
Розчинність осадів залежить від величини ДР осаду, а також від надлишку добавленого йону, що входить в склад осаду:
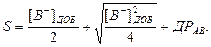 (2.17)
(2.17)
Добавлення сторонніх електролітів, що не мають спільних йонів з речовиною, яка випала в осад, спричинює збільшенню йонної сили розчину внаслідок чого розчинність осаду збільшується (сольовий ефект).
Так, наприклад у присутності 1 моль/л KNO3 розчинність PbSO4 збільшується в 14 разів, а в присутності 1 моль/л Al(NO3)3 – в 77 разів. Це пояснюється тим, що „сторонні” йони утримують йони „хазяїв” розчину у розчиненому стані, який перевищує розчинність малорозчинної солі в чистому розчиннику.
Розчинність важкорозчинних солей залежить від концентрації йонів гідрогену в розчині:
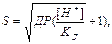 (2.18)
(2.18)
де КД – константа дисоціації кислоти [H+] = CHB-[HB ] – концентрація йонів гідрогену, що дорівнює різниці між загальною концентрацією кислоти і концентрацією її недисоційованої частини.
Залежність розчинності електролітів від йонної сили розчину. Основи теорії сильних електролітів, які розроблені П.Дебаем і Е.Хюккелем, придатні лише для розбавлених розчинів сильних електролітів до концентрації не вище ніж 1 . 10-3 моль/л.
За теорією кожний центральний йон оточений йонною сферою, що складається з негативно і позитивно заряджених йонів. Сумарний заряд йонів і йонної сфери дорівнює за величиною і протилежний за знаком заряду центрального йону. Потенціал йонної сфери  дорівнює:
дорівнює:
 (2.19)
(2.19)
де: zi – заряд йону, е – заряд електрону; Д – відносна діелектрична проникність розчинника;  - діелектрична проникність вакууму;
- діелектрична проникність вакууму;  - ефективний радіус йонної сфери (уподібнений радіусу провідної сфери із зарядом, що дорівнює заряду йонної сфери);
- ефективний радіус йонної сфери (уподібнений радіусу провідної сфери із зарядом, що дорівнює заряду йонної сфери);  - константа, яка дорівнює:
- константа, яка дорівнює:
 (2.20)
(2.20)
де сі – концентрація йону; NA – число Авогадро; k – константа Больцмана, Т – температура.
Для врахування відхилення властивостей концентрованих розчинів електролітів від теорії електролітичної дисоціації вводять поправку на ідеальність розчину  :
:
 (2.21)
(2.21)
де 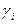 - коефіцієнт активності.
- коефіцієнт активності.
Коефіцієнт активності пов’язаний з активністю речовини аі:
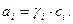 (2.22)
(2.22)
Мірою електричної взаємодії між йонами в розчині є йонна сила І:
 (2.23)
(2.23)
яка залежить від концентрації і зарядів йонів, що знаходяться в розчині.
У загальному випадку йонну силу розчину електроліту, що містить катіони і аніони визначають за виразом:
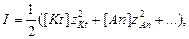 (2.24)
(2.24)
де [Kt], [An] – концентрації відповідно катіонів і аніонів, моль/л;  - заряди відповідно катіонів і аніонів.
- заряди відповідно катіонів і аніонів.
Залежність коефіцієнта активності йону від йонної сили розбавленого розчину виражається рівнянням Дебая-Хюккеля:
 (2.25)
(2.25)
а у випадку водних розчинів сильних одно-одновалентних електролітів з концентрацією до 1 . 10-3 моль/л за рівнянням:
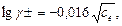 (2.26)
(2.26)
де се – концентрація електроліту.
Йонна сила для розчинів одно-одновалентних електролітів ( ) дорівнює:
) дорівнює:
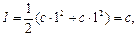 (2.27)
(2.27)
для одно-двовалентних (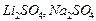 ) і дво-одновалентних (
) і дво-одновалентних (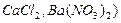 :
:
 (2.28)
(2.28)
для дво-двовалентних (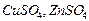 ):
):
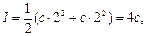 (2.29)
(2.29)
а для одно-тривалентних (К3РО4) і три-одновалентних (А1С13):
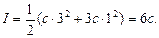 (2.30)
(2.30)
Якщо в розчині знаходиться суміш електролітів, то враховують сумарні концентрації кожного виду катіонів і аніонів, наприклад, йонна сила 0,001 М розчину 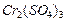 дорівнює:
дорівнює:

а коефіцієнт активності:
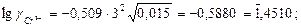



Активність йонів буде:
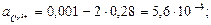

У випадку змішування розчинів, наприклад KNO3 і K2SO4 в суміші якого міститься 0,02 моль/л КС1 і 0,08 моль/л K2SO4 сумарна концентрація йонів калію становить
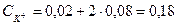 моль/л або 180 моль/м3.
моль/л або 180 моль/м3.
Тоді йонна сила розчину суміші солей буде:

Внаслідок сильної гідратації катіонів і слабкої гідратації великих полівалентних аніонів електроліти з багатовалентними катіонами мають вищі коефіцієнти активності ніж аналогічні електроліти з полівалентними аніонами:
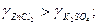
| 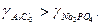
|
З однаковими аніонами коефіцієнти активності електролітів зменшуються в міру збільшення заряду катіона:

| 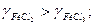
|

Коефіцієнти активності електролітів, які утворені одновалентними катіоном і аніоном, зменшуються в такому ряду:

| і |

якщо електроліти утворені одновалентними катіонами 
У випадку однакових катіонів коефіцієнти активності знижуються в міру збільшення заряду аніона:
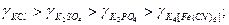
З одно-одновалентних електролітів з однаковими аніонами найбільші коефіцієнти активності мають кислоти, а коефіцієнт активності гідроксидів змінюється в зворотному порядку ніж одновалентних катіонів.
Слід відмітити, що високі коефіцієнти активності мають хлорати (VII) двовалентних металів.
Зі зростанням концентрації розбавлених розчинів електролітів коефіцієнт активності зменшується. При цьому крива залежності в багатьох випадках має мінімум, яка при подальшому підвищенні концентрації зростає і може набувати великих значень.
У сильно розбавленому розчині, важкорозчинного електроліту, коли:
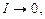
процес розчинення вже не залежить від йонної сили розчину, при добавленні до нього добре розчинного сильного електроліту відбувається збільшення не тільки йонної сили розчину, а і розчинності важкорозчинного електроліту. Це пояснює механізм сольового ефекту, розглянутого раніше. Для одно-одновалентного електроліту в цьому випадку добуток розчинності виражається як:
 (2.31)
(2.31)
де  і
і  - відповідно розчинність і коефіцієнт активності при І = = 1.
- відповідно розчинність і коефіцієнт активності при І = = 1.
Йонно-молекулярні рівняння в розчинах електролітів. Вивчення рівноважних йонно-молекулярних рівноваг в останній час актуально в агрохімії для характеристики степеню рухливості йонів ґрунтового розчину і в особливості грунтових фосфатів.
Грунт представляє собою складну багатофазну систему, тому мінеральний фосфор в грунтовому розчині бере участь в багатьох рівноважних реакціях. Це реакції, які відбуваються тільки між рідкими фазами або тільки між твердими фазами, - гомогенні рівноваги:
РРОЗЧИН L РРОЗЧИН
- реакції, що відбуваються з великими швидкостями,
РТВ.ФАЗА L РТВ.ФАЗА
- реакції, що відбуваються з малими швидкостями.
Реакції, що відбуваються між твердими і рідкими фазами – гетерогенні рівноваги:
РГРУНТ L РРОЗЧИН.
В результаті гомогенних реакцій ортофосфатна кислота і відповідні її йони 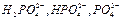 утворюють прості і складні солі, розчинні комплексні сполуки, які знаходяться між собою в рівновазі.
утворюють прості і складні солі, розчинні комплексні сполуки, які знаходяться між собою в рівновазі.
Гетерогенні реакції включають розчинність і осадження важкорозчинних фосфорних солей, які характеризуються добутком розчинності цих сполук і адсорбцією фосфору на поверхні грунтових частинок.
При внесенні в грунт фосфатних добрив, наприклад, гідрогенфосфату амоніаку, що містить вільну ортофосфатну кислоту під час розчинення солі відбувається вивільнення йонів за рахунок гідролізу катіонів слабкої основи:
NH4+ + H2O L NH4OH + OH-
та аніонів ортофосфатної кислоти за реакціями:
PO43- + H2O L HPO42- + OH- ;
HPO42- + H2O L H2PO42- + OH- ;
H2PO4- + H2O L H3PO4 + OH- .
Відповідно до констант йонізації гідроксиду амоніаку та ортофосфатної кислоти в грунтовому розчині встановлюються такі рівноваги:
NH4OH L NH4+ + OH-;
H3PO4 L H+ + H2PO4-;
H2PO4- L H+ + H2PO42-;
HPO42- L H+ + PO43-.
Вміст окремих фосфат-йонів в грунтовому розчині можна розглядати, як функцію величини [H+] (рис.2.8).

|
| Рис.2.8. Розподіл вмісту йонів ортофосфатної кислоти (С) при різних значеннях рН |
Для кількісного розрахунку йонного складу розчину скористуємося рівняннями констант йонізації наведених сполук:
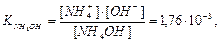
для ортофосфатної кислоти:

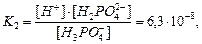
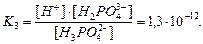
На стан рівноваги в розчині впливає рівновага дисоціації води, що описується відомою константою  :
:

Виходячи з умов електронейтральності для грунтового розчину, який розглядається, маємо рівновагу:

Кількість Нітрогену, Фосфору і Гідрогену в розчині можна розрахувати за рівнянням:
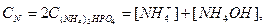
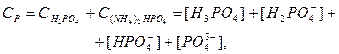

Враховуючи рівняння констант йонізації ортофосфатної кислоти і після перетворень маємо:




Застосувавши рівняння констант дисоціації гідроксиду амоніаку і води, концентрацію нітрогенвмісних речовин можна виразити через концентрацію йонів Гідрогену:

Таким чином, на підставі отриманих залежностей і рівняння матеріального балансу за йоном гідрогену після перетворень маємо тільки одну невідому величину:

Це рівняння розв’язують методами обчислювальної математики на ЕЦОМ.
З графічної залежності (рис.2.8) випливає, що в грунтовому розчині більшості грунтів (рН = 3,5 - 8,5) присутні головним чином йони  і
і 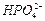 . Таким чином, загальний вміст Фосфору в грунтовому розчині (СР) визначається за рівнянням:
. Таким чином, загальний вміст Фосфору в грунтовому розчині (СР) визначається за рівнянням:
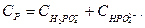
Концентрації ортофосфатної кислоти виражають через активності відповідних йонів, тоді рівняння дисоціації кислоти приймають вигляд:

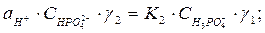
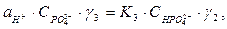
де 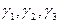 - коефіцієнти активностей відповідно одно-, дво-, трьохзарядних йонів ортофосфатної кислоти.
- коефіцієнти активностей відповідно одно-, дво-, трьохзарядних йонів ортофосфатної кислоти.
Підставляючи  маємо:
маємо:

Після перетворень значення активності монофосфатного йону дорівнює:

Для дифосфатного йону аналогічно маємо:
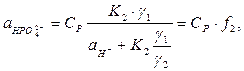
де  - активність йонів Гідрогену (визначається із значень рН), К2 = 6,3 . 10-8 – друга константа дисоціації Н3РО4,
- активність йонів Гідрогену (визначається із значень рН), К2 = 6,3 . 10-8 – друга константа дисоціації Н3РО4, 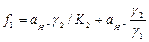 і
і  - корелюючи фактори, які встановлюють частку вмісту йонів
- корелюючи фактори, які встановлюють частку вмісту йонів  і
і 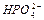 в загальному вмісту Фосфору в розчині.
в загальному вмісту Фосфору в розчині.
Гетерогенні реакції в грунті відбуваються, наприклад, при вапнуванні сильно кислих грунтів. При наявності в грунті вільної ортофосфатної кислоти в її розчині відбувається розчинення карбонату кальцію.
В процесі розчинення карбонат кальцію дисоціює за рівнянням:
CаCO3 L Са2+ + СO32-.
При постійній температурі умова дисоціації характеризується добутком розчинності і розчинністю (S) карбонату кальцію:


В рівноважній гетерогенній системі необхідно враховувати інші рівноваги:

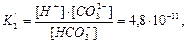
а також рівноваги ортофосфатної кислоти (див.вище).
За умовою матеріального балансу розчинність карбонату кальцію дорівнює:
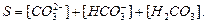
Перетворюючи ці рівняння рівняння матеріального балансу розчинності карбонату кальцію набуває вигляду:

Рівняння умови електронейтральності рівноважного розчину з урахуванням впливу ортофосфатної кислоти має вигляд:
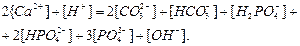
Підставляючи вирази розчинності  , а також за допомогою матеріального балансу ортофосфатних компонентів розчину
, а також за допомогою матеріального балансу ортофосфатних компонентів розчину
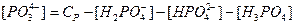
рівняння умови електронейтральності набуває вигляду:

При цьому концентрацією гідроксид-йонів [OH-] в умовах кислого середовища знехтуємо.
Рівноважні концентрації карбонатвмісних сполук можна записати, скориставшись виразами констант рівноваги карбонатної кислоти і умовою матеріального балансу розчинення карбонату кальцію, за допомогою рівноважної концентрації йонів гідрогену і констант йонізації:

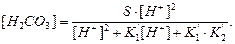
Рівняння умови електронейтральності з урахуванням рівнянь констант йонізації Н3РО4, в яких Н3РО4=СР, а  , рівняння матеріального балансу розчинності
, рівняння матеріального балансу розчинності 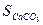 набуде вигляду:
набуде вигляду:

Розв’язування цього рівняння дає можливість визначити рівноважну концентрацію [H+].
Запитання для самоконтролю
1. Чи залежить величина радіуса йонної атмосфери від концентрації йонів, їх природи, природи розчинника? Зробіть оцінку радіуса йонної атмосфери для 0,001 і 0,01 молярних розчинів 1,1- заряджених електролітів у воді згідно 1 наближенню теорії Дебая-Гюккеля.
2. Як відрізняють значення коефіцієнтів активності водних розчинів: а) КС1 і NaC12, б) КС1 і ВаС12, в) ВаС12 і BaSO4, якщо розчини однакової йонної сили (І випадок) і однакової молярної концентрації (ІІ випадок)?
3. Чому значення коефіцієнтів активності розчинів: КС1 у воді і КС1 в метиловому спирті відрізняються між собою? Відповідь підтвердити розрахунком.
4. Для 0,001 молярного водного розчину електролітів: NaCl, BaCl2, Na2SO4, ZnSO4 розрахувати значення коефіцієнтів активності  за рівнянням теорії Дебая-Гюккеля і порівняти їх з довідковими.
за рівнянням теорії Дебая-Гюккеля і порівняти їх з довідковими.
5. Обчислити коефіцієнти активності та активності йонів 0,01 М розчину Al2(SO4)3.
6. Як зміниться коефіцієнт активності 0,01 молярного водного розчину NaCl, якщо до нього добавили 0,015 моль/л Fe2(SO4)3 (T = 298 К)?
7. Визначити концентрацію йонів гідрогену і рН 0,5 %-го розчину сульфатної кислоти.
8. Як зміниться розчинність AgBrO3 в 0,02 молярному водному розчині AgNO3 порівняно з його розчинністю у воді (S = 0,0018 моль/л)?
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 785; Нарушение авторских прав?; Мы поможем в написании вашей работы!