
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 6. Фізико-хімія дисперсних систем та розчинів високомолекулярних сполук 5 страница
|
|
|
|
Кінетика коагуляції. Кількісною мірою процесу коагуляції є швидкість коагуляції, яка характеризується зміною чисельної концентрації часточок за одиницю часу 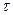 :
:
 (6.39)
(6.39)
На рис.6.25 показана залежність швидкості коагуляції від концентрації електроліту.

|
| Рис.6.25. Залежність початкової швидкості коагуляції від концентрації електроліту: І – зона стійкого золю; ІІ – зона повільної коагуляції; ІІІ – зона швидкої коагуляції, СК.П і СК.Ш – поріг повільної і швидкої коагуляції |
Графічну залежність можна поділити на три частини:
І – зона стійкого золю, коагуляція не відбувається;
ІІ – зона повільної коагуляції, швидкість визначається як числом ефективних зіткнень, так і впливом різних факторів, які впливають на висоту потенціального бар’єра між часточками, що наближаються; зі збільшенням концентрації даного електроліту швидкість коагуляції збільшується;
ІІІ – зона швидкої коагуляції, коагуляція визначається тільки кількістю зіткнень і не залежить від інтенсивності факторів, що впливають на взаємодію між часточками, зокрема від концентрації електроліту.
Згідно з теорією швидкої коагуляції М.Смолуховського (1917 р.) процес коагуляції описується кінетичним рівнянням хімічної реакції другого порядку:
 (6.40)
(6.40)
Після інтегрування рівняння в межах від  до
до  дістанемо:
дістанемо:
 (6.41)
(6.41)
де К = 4 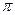 DR; D – коефіцієнт дифузії; R – радіус сфери дії сил притягання.
DR; D – коефіцієнт дифузії; R – радіус сфери дії сил притягання.
При умові половинної коагуляції (θ) рівняння набуває виразу:
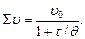 (6.42)
(6.42)
Величина θ для кожної дисперсної системи є постійною, тому її застосовують для характеристики дисперсних систем.
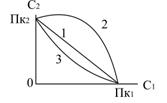
Коагуляцію дисперсних систем можна викликати і за допомогою суміші електролітів. При коагуляції сумішу електролітів спостерігаються три ефекти: адитивність, антагонізм і синергізм електролітів (рис.6.26).
Адитивність суміші електролітів полягає в тому, що кожний електроліт діє окремо (рис.6.26, пряма 1). Якщо пороги коагуляції електролітів дорівнюють  і
і  , а їх концентрації С1 і С2, то адитивність такої суміші характеризується рівнянням:
, а їх концентрації С1 і С2, то адитивність такої суміші характеризується рівнянням:
 (6.43)
(6.43)
На графіку (рис.6.26) пряма 1 сполучає значення порогів коагуляції  і
і  кожного окремого електроліту. Адитивність спостерігається у йонів однакового заряду і близьких за властивостями (K+ і Na+, Cl- і Br -).
кожного окремого електроліту. Адитивність спостерігається у йонів однакового заряду і близьких за властивостями (K+ і Na+, Cl- і Br -).
|
Рис.6.26. Схема дії двох електролітів при коагуляції:
1 – адитивність; 2 – антагонізм; 3 – синергізм;
 і і  - пороги коагуляції електролітів - пороги коагуляції електролітів
|
При антагонізмі електролітів вони протидіють один одному, і для досягнення коагуляції дисперсної системи необхідно більше відповідної частки кожного з них, ніж з правилом адитивності (рис.6.26, крива 2). Приклади антагонізму є коагуляція AgJ сумішу Al(NO3)3 і K2SO4.
Синергізмом називають взаємне посилення коагулюючої дії одного електроліту при додаванні другого. Для досягнення коагуляції дисперсної системи їх потрібно менше, ніж це необхідно за правилом адитивності (рис.6.26, крива 3). Синергізм виявляється, наприклад, при дії суміші LiCl і CaCl2 на колоїдний розчин HgS.
Коагуляція може відбуватися і при взаємодії двох стійких колоїдних систем, в яких часточки мають протилежні заряди. Такі колоїдні системи виявляють максимальний вплив один до одного, якщо сумарний заряд їх часточок дорівнює нулю. Причиною взаємної коагуляції (гетерокоагуляції) є електростатичне притягання.
Окремий випадок цього явища спостерігається при взаємодії однойменно заряджених колоїдних систем, яку пояснюють хімічною і адсорбційною взаємодією.
Часточки дисперсних систем взаємодіють також з твердим тілом, поверхня якого має протилежний за знаком заряд. Утворення коагулянту на таких тілах називається гетероадагуляцією.
Наряду з розглянутими вище механізмами коагуляції важливе значення має і так звана ортокінетична коагуляція. Так при седиментації крупні часточки, що рухаються з великою швидкістю, можуть доганяти повільно осідаючі часточки і „захоплювати” їх. Осідаюча крупна часточка здатна захопити більш дрібні, центр яких знаходиться в деякому прямовисному циліндрі з віссю, що проходить через центр більш крупної часточки; основа цього циліндру називається перерізом захоплювання (рис.6.27). Самі дрібні часточки дифундують по поверхні більш крупної часточки внаслідок обтікання її рідиною; наближення часточок обумовлено дією інерційних сил, які виникають на початку обтікання (J).

|
| Рис.6.27. Схема ортокінетичної коагуляції: r1 - радіус крупної осідаючої часточки; r2 – радіус мілкої седиментуючої часточки |
Явище взаємної коагуляції широко використовується для руйнування колоїдних систем, зокрема в нафтодобувної промисловості, для очищення ґрунтових вод, промислових стоків.
Гетрокоагуляція і ортокінетична коагуляція лежать в основі ґрунтоутворюючих процесів; з їх протіканням пов’язані процеси водоочистки, пінної флотації, вловлювання пилу, аерозолів, штучного утворення осадів з хмар, тощо.
Порушення стійкості дисперсних систем під впливом розчинів ВМС. Дисперсні системи, до яких додаються розчини ВМС, в значній мірі втрачають стійкість, тобто сенсибілізують. Поріг коагуляції таких систем менший, ніж для вихідних. Це пов'язано з адсорбцією макромолекули полімеру одночасно на поверхні декількох часточок дисперсної системи. Утворюючи між часточками дисперсної фази „містки” макромолекули полімеру настільки порушують стійкість дисперсної системи, що вона утворює об’ємний пухкий осад. Така адсорбційна коагуляція називається флокуляцією. Частинки осаду-флокули добре фільтруються тому, що при взаємодії адсорбційних шарів полімерів між ними виникають сили відштовхування. Внаслідок цього проміжні ділянки макроланцюга полімеру між адсорбованими ділянками перебувають у розчині подалі від поверхні часточок.
Сили відштовхування мають ентропійну природу. Таке ентропійне відштовхування називають стеричним захистом. Він діє коли відстань між поверхнями часточок не перевищує подвійну товщину адсорбційного шару полімеру.
Стійкість розчинів ВМС. Порушення стійкості розчинів ВМС досягається шляхом погіршення їх розчинності. Для цього змінюють температуру, додають розчинники або електроліти. При цьому відбувається виділення ВМС з розчину. Цей процес називають висолюванням.
Дослідженнями встановлено, що на висолювання гідрофільних полімерів впливають як аніони, так і катіони. Висолююча дія аніонів відображається рядом (ряд Гофмейстера):
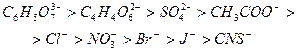
Катіони мають менший висолюючий ефект, їх можна розмістити в такий ліотропний ряд:
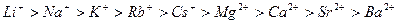 .
.
Висолююча дія йонів залежить від їх зарядів, якщо концентрації цих йонів однакові. Це пояснюється більшою гідратацією йонів з більшою величиною заряду порівняно з меншою.
На висолювання високомолекулярних сполук значно впливають рідини, які добре розчиняються в дисперсійному середовищі, і практично не розчиняють полімер. Приклади такої рідини є етиловий спирт. За допомогою спирту і суміші спирту з етером висолюються практично повністю більшість гідрофільних полімерів.
Явище висолювання характеризується оборотністю. Оборотність цього явища полягає в тому, що після видалення з осаду полімеру електроліту полімер знову може розчинятися з поновленням основних властивостей, які мав розчин до висолювання.
Під час змішування розчинів ВМС з розчинами електролітів, з ацетоном, спиртом, з розчинами інших ВМС тощо, можуть утворюватись краплі рідкого ВМС. З часом краплі зливаються і у вигляді концентрованого розчину ВМС осідають на дно, а зверху залишається шар більш розведеного розчину ВМС. Концентрований шар ВМС називають коацерватом, а явище, при якому утворюється коацерват, називається коацервацією.
Коацервацію вважають незакінченим, початковим процесом висолювання, при якому міцели втрачають дифузний шар і зберігають гідратний шар, молекули якого з’єднуються в рідкі краплі коацервату. Наприклад, якщо до розчину альбуміну поступово добавляти концентрований розчин Na2SO4, утворюється коацерват альбуміну.
Явище коацервації широко використовується для фракціонування природних і синтетичних високомолекулярних сполук.
Грубодисперсні системи. Природа стійкості багатьох систем в значній мірі залежить від фазового стану дисперсної системи. Дисперсні системи з різним агрегатним станом: аерозолі, суспензії, емульсії і піни відносяться до грубодисперсних систем. Часточки цих систем більші за розміром ніж колоїдні.
Деякі біологічні системи – мікроорганізми, синьо-зелені водорості, спори рослин, тваринні і рослинні мембрани тощо, за своїми властивостями також відносяться до грубодисперсних систем.
Піни. Піна – дисперсія газу або повітря в рідкому або твердому середовищі. Тому існують як рідкі так і тверді піни. Піни представляють собою типову ліофобну систему. Розрізняють розбавленні дисперсії газу в рідині, які називаються газовими емульсіями. Такі піни містять більше 70% газової фази в об’ємі піни. У концентрованих пінах газоподібна фаза є основною (до 99% об’єму) частиною системи. В якості характеристики концентрації піни користуються відношенням об’єму піни до об’єму рідини, що міститься в ній. Цю величину називають кратністю піни. За цією характеристикою піни поділяються на розбавлені і концентровані.
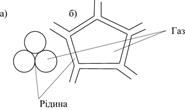
|
| Рис.6.28. Схеми будови комірок пін: а – сферичної; б – п’ятикутної |
В пінах комірки, які заповнені газовою фазою (повітрям) розділені тонкими плівками дисперсійного середовища (рис.6.28). Комірки можуть мати правильну сферичну форму (рис.6.28, а), а при стикуванні комірок вони набувають форму багатогранників (рис.6.28, б). Характерною коміркою пін є пентагональний додекаєдр. Це дванадцатигранник з п’ятикутними гранями, що має 30 ребер і 20 вершин (рис.6.29). Ребрами пінної комірки є канали Плато, які заповнені дисперсійним середовищем. В одному каналі такої комірки можуть збігатися тільки три плівки, які розташовані під кутом 1200.

|
| Рис.6.29. Комірка пентагонального додекаедру |
Площа перерізу каналу Плато має форму „трикутника з увігнутими боками”.
Вершини сусідніх пентагональних додекаедрів утворюють вузли, в яких збігаються чотири канали. Канали і вузли утворюють єдину розгалужену систему в якій відбувається перенесення дисперсійного середовища, а також її стікання під дією сил тяжіння.
В реальних системах на початку утворення піна може бути монодисперсною, але внаслідок розриву плівок стає полідисперсною. При цьому завжди зберігається правило Плато: три плівки утворюють канал, чотири канали утворюють вузол (вершину).
Утворення стійких пін можливе тільки при наявності стабілізаторів-піноутворювачів. Піноутворювачами є ПАР, які поділяють на два типи: 1) першого роду – зменшують величину поверхневого натягу (нижчі спирти і кислоти); 2) другого роду – на поверхні розподілу утворюють міцні адсорбційні драглеподібні плівки (мила, алкалоїди, таніни, деякі барвники, білки, карбометилцелюлоза тощо).
Піни, що утворюються за допомогою піноутворювачів, мають велику механічну міцність структурованих адсорбційних шарів. Стінки комірок таких пін можна розглядати як такі, що утворені двома двомірними конденсованими (твердими) плівками.
Рідини, які здатні тверднути, утворюють тверді піни (пемза, пінопласт, пінополістирол тощо).
Піни широко використовуються в різних областях сучасної техніки: при гасінні пожеж (особливо нафтових родовищ, продуктів її крекінгу), при флотаційному збагаченні руд, у виробництві харчових і кондитерських продуктів (хліб – це приклад твердої піни), теплоізоляційних матеріалів (мікропориста гума, пінобетон, пориста цегла).
Добування пін, як правило, відбувається шляхом диспергування повітря або газів в рідині, яке містить ПАР. Диспергування газу відбувається в шарі рідини (барботажні піни) або за допомогою мішалок в об’ємі рідини. Також застосовують піногенератори різних конструкцій. Утворення піни в них відбувається на сітках, що встановлені на шляху газорідинного потоку. Такі піногенератори забезпечують утворення великої кількості піни необхідної кратності, що дозволяє швидко гасити пожежі і особливо горіння різних речовин.
Піни одержують також конденсаційним методом, при якому відбувається виділення будь-якого газу, що утворюється за рахунок хімічної реакції або біохімічного процесу. Так у вогнегасниках відбувається хімічна реакція:
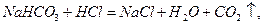
при виробництві газобетону:
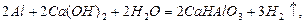
а випіканні хліба:

Руйнування пін супроводжується зміною параметрів, що характеризують будову і властивості пін. Тобто відбувається потоншення і розрив плівок комірок, ізотермічна перегонка газової фази від дрібних комірок до більш крупних, а також синерезису – витікання дисперсійного середовища (рідини) із каналів Плато під дією сил тяжіння.
В багатьох випадках піноутворення є небажаним явищем. Тому руйнування (гасіння) пін або припинення піноутворення є важливою задачею у багатьох технологічних процесах. Так, велика кількість рясної піни може утворюватися в хімічних процесах, у мікробіологічному виробництві, що пов’язано з виділенням газів або їх взаємодією з рідинами, надмірна кількість піни утворюється при кипінні рідин в котлах, при роботі пральних машин, мішалок. У цих випадках гасіння пін досягається використовуванням ПАР, які більш поверхнево-активні ніж ті, що наявні в початковій системі піноутворення. Такі ПАР сприяють самовільному руйнуванню пін.
Піни, що утворюються, можна руйнувати за допомогою різних методів: дією перегрітої пари, ультразвуку, або введенням піногасників. Піногасники – це ПАР, які мало розчиняються у воді, але швидко розтікаються на її поверхні у вигляді мономолекулярного шару. Вони витискають піноутворювачі з поверхневого шару плівки і тим самим на декілька порядків знижують стійкість пін. Піногасниками можуть бути середні гомологи спиртів, поліаміди жирних кислот, рідкі жирні кислоти і їх гліцериди, пропіленгліколі і їх похідні, силіконові масла.
Емульсії. Емульсіями називаються дисперсії рідин в рідких дисперсійних середовищах, які взаємно нерозчинні. У зв’язку з цим часточки дисперсної фази і дисперсійного середовища повинні різко відрізнятися за полярністю. Тому особливістю емульсій є можливість утворення емульсій двох типів: прямої і оберненої. Більш полярною рідиною звичайно є вода (В), малополярну рідину прийнято називати „масло” (М). В зв’язку з цим пряму емульсію позначають М/В (емульсії І роду), а обернену – В/М (емульсії ІІ роду). Можливі також так звані „множинні емульсії”, в яких дисперсійне середовище частково дисперговане в краплинах дисперсної фази.
Емульсії за концентрацією дисперсної фази поділяють на три групи: 1) розведені (з концентрацією дисперсної фази не вище 0,1% об’єму емульсії); 2) концентровані (з концентрацією дисперсної фази 0,1-70% об’єму); 3) висококонцентровані (з вмістом дисперсної фази вище 70% об’єму емульсії). Висококонцентровані емульсії за структурою і властивостями подібні пінам, тому їх іноді називають спумоїдними (піноподібними) емульсіями (рис.6.30).

|
| Рис.6.30. Схематичне зображення емульсії: а – розбавленої; б – висококонцентрованої |
Стійкість емульсій, у першу чергу, залежить від концентрації дисперсної фази. В більш стійкої розведеної емульсії краплі рідини (які є монодисперсними (рис.6.30, а) зливаються одна з одною (коалесціюють), і система швидко розшаровується. Висококонцентровані емульсії менш стійкі. На відміну від розведених висококонцентровані емульсії мають частинки більших розмірів і різної форми (рис.6.30, б). Такі емульсії називають полідисперсними.
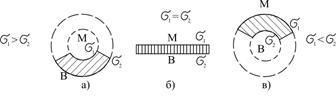
Утворення стійких емульсій можливе при застосуванні стабілізаторів, які називають емульгаторами. Це звичайні та високомолекулярні ПАР (окси- і сульфоспирти, солі і амінопохідні жирних кислот, амонієві основи, білки, сапонін, крохмаль, казеїн, желатина, полакриламід, поліоксиетилен та ін.). Емульгатор адсорбується на межі поділу фаз і при цьому зменшує питому вільну поверхневу енергію. Такий міжфазовий шар (МФШ) має будову, яка зображена на рис.6.31, б.
Якщо розчинна у воді і нерозчинна в маслі ПАР приводить до зниження поверхневого натягу на межі МФШ – вода утворюється емульсія типу М/В і навпаки, якщо ПАР розчинна в маслі утворюється емульсія типу В/М (рис. 6.31, а і в).
При певних умовах спостерігається обернення фаз емульсій, тобто коли емульсія даного типу при введенні будь-яких реагентів або при зміні умов перетворюється в емульсію протилежного типу.
|
| Рис.6.31. Схеми форми міжфазового шару емульсій залежно від поверхневого натягу з боку „масляної” і водної фаз |
Щоб визначити тип емульсії застосовують різні методи. Так, додавання до емульсії фарби, яка розчиняється тільки в одній з рідин (водорозчинної або маслорозчинної) відповідне забарвлення має можливість визначити тип емульсій. Інколи застосовують метод розбавлення. Якщо емульсія легко розбавляється водою, то вода є дисперсійним середовищем, тобто це емульсія типу М/В і навпаки емульсія типу В/М легко розбавляється „маслом”.
Тип емульсії можна встановити також кондукторометричним методом. Якщо дисперсійним середовищем є вода, електропровідність якої висока, то це емульсія типу М/В. В той же час електрична провідність емульсій типу В/М дуже низька.
Під дією ультрафіолетового випромінювання в темряві емульсії В/М флуоресціюють на відміну емульсій типу М/В, які забарвлення звичайно не набувають.
Легко встановити тип емульсії нанесенням краплини емульсії на фільтруваний папір. Якщо пляма швидко розпливається, а в центрі залишається невелика краплинка („масло”), то це емульсія типу М/В.
Тип емульсії залежить від властивостей поверхні емульгатора. За правилом Банкрофта рідина в якої розчиняється емульгатор вважається дисперсійним середовищем.
Це означає, що гідрофільні емульгатори сприяють утворенню емульсій типу М/В, а гідрофобні – типу В/М. Механізм стабілізуючої дії емульгаторів полягає в утворенні на частинках дисперсної фази захисних оболонок, які запобігають їх зливанню. Їх дія залежить від співвідношення гідрофільних і ліпофільних ділянок молекули емульгатора. Це співвідношення називають гідрофільно-ліпофільним балансом (ГЛБ).
Значення ГЛБ для деяких молекул ПАР приведені в табл.6.5.
Таблиця 6.5
Значення деяких ПАР
| ПАР | ГЛБ |
| Олеїнова кислота | 1,0 |
| Бутанол | 7,0 |
| Олеат натрію | 18,0 |
| Лаурилсульфат натрію | 40,0 |
Великі значення ГЛБ відповідають гідрофільним ПАР, що стабілізують прямі емульсії. Навпаки, малі значення ГЛБ характерні для олеофільних ПАР, що стабілізують обернені емульсії.
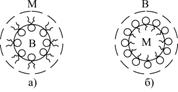
Найбільшу емульгуючу дію мають мила лужно-земельних металів, які стабілізують емульсії типу В/М і лужні мила, що стабілізують емульсії типу М/В (рис.6.32).
|
| Рис.6.32. Схема стабілізації емульсії В/М (а) і емульсіх М/В лужним милом (б) |
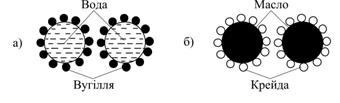
Наочним прикладом утворення структурно-механічного бар’єру, що є сильним фактором стабілізації дисперсій, може розглядатися стабілізація емульсій тонко подрібненими порошками. У випадку крапель води, що покриті гідрофобним порошком, наприклад вугіллям, в масляній фазі вода відтискується з прошарків між часточками внаслідок гідрофобності вугілля, і при зіткненні краплини води не можуть увійти в безпосередній контакт (рис.6.33, а). Навпаки, гідрофільний порошок, наприклад крейда (СаСО3) захищає собою масляну фазу і не дозволяє увійти в контакт краплинам масла в водному дисперсійному середовищі (рис.6.33, б).
У більшості випадків емульсії одержують диспергуванням у спеціальних апаратах – гомогенізаторах, або в колоїдних млинах.
Застосовують також ультразвукове диспергування, конденсацію частинок дисперсної фази у воді, протискання рідини крізь сита з дуже малими отворами під тиском. Найпростіший спосіб – це інтенсивне перемішування або збовтування рідин. У всіх випадках необхідна присутність відповідного емульгатора.
|
| Рис.6.33. Схема стабілізації емульсій гідрофобними (а) і гідрофільними (б) порошками |
Найважливішим представником природних емульсій є сира нафта, яка містить – 6-% засоленої води і дуже сильно стабілізована природними ПАР і смолами. Широке застосування мають емульсії в техніці й хімічній технології: це процеси механічної обробки з застосуванням емульсійних мастило-охолоджувальних рідин, емульсійної полімеризації, переробки і добування харчових продуктів (молоко, вершкове масло, майонез, маргарин) і фармацевтичних препаратів для внутрішнього вживання і як зовнішні засоби.
Процеси руйнування емульсій наближені за природою і механізмами протікання до процесів руйнування пін. В розбавлених емульсіях відбувається седиментація краплин: вгору – при меншій густині дисперсійної фази (наприклад, утворення вершків) або вниз – в зворотньому випадку.
На процес седиментації може накладатися агрегування краплин емульсії. Це явище називається флокуляцією. Флокуляція приводить до збільшення ефективного розміру агрегатів, що осідають, а також до збільшення швидкості їх осідання.
Велика увага приділяється розробці методів руйнування емульсій (деемульгування). Так, руйнування емульсії сирої нафти є першою і достатньо важкою стадією переробки нафти. Часто емульсії руйнують центрифугуванням, додаванням електролітів, сильних реагентів (кислот), ПАР, нагріванням, заморожуванням або накладанням електричного поля.
Драглі. Дисперсні системи, а також розчини ВМС, які здатні желатинуватись, тобто створювати драглисту масу з властивостями напіврідинного, напівтвердого тіла, називаються драглями або гелями.
Коагуляція седиментаційно-стійких вільнодисперсних систем (золів) може не супроводжуватися наочним седиментаційним розшаровуванням системи. Це постерігається в тих випадках, коли агрегування часточок призводить до розчинення суцільної просторової сітки часточок, які заповнюють весь об’єм системи, тобто до утворення зв’язанодиперсної системи – гелю. В зв’язанодисперсних системах часточки можуть залишатися розділеними прошарками дисперсійного середовища, або може відбутися повне витіснення останнього. При цьому відбувається безпосередній контакт для твердих часточок і повне зливання – для краплин і пухирців.
Прикладом некристалічних конденсаційних дисперсних структур є силікати (сикагелі). Силікагелі утворюються при виділенні нової аморфної фази при взаємодії силікату натрію з кислотою:
Na2SiO3 + 2HCl + H2O 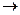 2NaCl + Si(OH)4,,
2NaCl + Si(OH)4,,
(HO)3 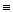 Si – OH + HO – Si
Si – OH + HO – Si 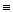 (OH)3 + …
(OH)3 + … 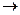
(OH)3  Si – [- O – Si(OH)2 -]n – O – Si
Si – [- O – Si(OH)2 -]n – O – Si  (OH)3 + (n-1)H2O.
(OH)3 + (n-1)H2O.
За спільними характеринми властивостями гелі поділяють на: ліогелі, які містять велику кількість рідини (кисіль, кисле молоко, холодець, драглі силікатної кислоти тощо); ксерогелі – висушені ВМС (желатина, целюлоза, шкіра, шерсть, каучук, ріг тощо); аерогелі – високопоруваті ксерогелі (силікагель, вугілля).
Під впливом дії тих або інших факторів (старіння, температура, механічної дії) ряд гелів змінює гідрофільність та інші властивості. Так, борошно має здатність зв’язувати воду, утворюючі тісто, яке при випіканні досягає максимальної гідрофільності (з 44 % до 82,7 %). Під час зберігання хліба зв'язана вода поступово втрачається, тобто відбувається старіння (черствіння) хліба, який містить 67,4 % води.
При утворенні драглів відбувається процес гелеутворення, тобто желатинування. Желатинування є процесом переходу колоїдного розчину (або полімеру) в драглі, який відбувається без відокремлення дисперсної фази від дисперсійного середовища. Разом з цим не відбувається порушення того співвідношення їх, яке було у вихідному золі. Желатинування обмежується об’ємним захопленням дисперсійного середовища часточками дисперсної фази (іммобілізацією). Процес коагуляції і желатинування пов’язаний з структуроутворенням подовженої форми часточок дисперсної фази, яке супроводжується їх певною орієнтацією і взаємодією. Ці часточки з’єднуються мж молекулами або хімічними силами зв’язку і створюють механічну стійку структуровану сітку, яка рівномірно заповнює зайнятий розчином простір (рис.6.34). Утворення гелю проходить через ряд послідовних стадій:
  
|
| Рис.6.34 |
Si(OH)4  Колоїдні часточки (золь)
Колоїдні часточки (золь)  Сітка часточок (драглі)
Сітка часточок (драглі)

Розбавлений золь  Слабкі драглі або осад
Слабкі драглі або осад

Концентрований золь  Міцні тверді драглі
Міцні тверді драглі

Вологі драглі  Висушені драглі,
Висушені драглі,
або
Структуроутворювання  Желатинування
Желатинування 
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 2079; Нарушение авторских прав?; Мы поможем в написании вашей работы!