
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 6. Фізико-хімія дисперсних систем та розчинів високомолекулярних сполук 4 страница
|
|
|
|
Явище, протилежне електроосмосу, є потенціал течії або перебігу (Квінке, 1859 р.). Потенціал, який виникає при протіканні рідини під тиском через пористу мембрану, називають потенціалом протікання. Він виникає внаслідок руху зарядів (йонів дифузного шару) вздовж межі поділу фаз в напрямку потоку рідини. Ця різниця потенціалів на кінцях капілярів діафрагми приводить до появи струму провідності в зворотному напрямку. При рівновазі струмів потенціал протікання (UПРОТ) дорівнює:
 (6.15)
(6.15)
де 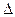 Р – тиск, який викликає течію рідини.
Р – тиск, який викликає течію рідини.
При осіданні часточок дисперсної фази по висоті стовпа рідини виникає різниця потенціалів (ефект Дорна, 1878р.). Це явище обернене електрофорезу. Потенціал, який виникає, називається потенціалом седиментації. Причиною цього явища є розділення йонів дифузних шарів і колоїдних часточок, що рухаються при осіданні, внаслідок їх тертя об шар рідини. При цьому дифузні йони відстають від колоїдних часточок і по висоті виникає різниця потенціалів.
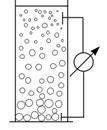
|
| Рис.6.19. Схема експерименту Дорна з седиментації |
Величину потенціалу седиментації (UСЕД) обчислюють за рівнянням:
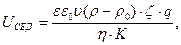 (6.16)
(6.16)
де  - об’ємна доля дисперсної фази (для сферичних часточок радіусом r і кількістю n
- об’ємна доля дисперсної фази (для сферичних часточок радіусом r і кількістю n  дорівнює
дорівнює 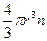 ; ρ і ρ0 - густина дисперсної фази і дисперсійного середовища; q – прискорення сили тяжіння.
; ρ і ρ0 - густина дисперсної фази і дисперсійного середовища; q – прискорення сили тяжіння.
Значення  -потенціалу часточок колоїдних розчинів знаходиться в межах 1,5-75 мВ. Електрофоретична рухливість часточок золів має значення порядку 0,4-0,8.10-8 м-2/с.В, а експериментальні значення електрофоретичної рухливості часточок досягають
-потенціалу часточок колоїдних розчинів знаходиться в межах 1,5-75 мВ. Електрофоретична рухливість часточок золів має значення порядку 0,4-0,8.10-8 м-2/с.В, а експериментальні значення електрофоретичної рухливості часточок досягають  5,0 . 10-8 м-2/c.В.
5,0 . 10-8 м-2/c.В.
Методи електрофорезу дають змогу аналізувати суміші біологічних рідин, розділяти їх на компоненти, визначити чистоту біологічних препаратів. Електрофорез застосовують в медичній діагностиці, в лікувальній справі, при нанесенні оксидів металів на поверхні радіовиробів тощо.
Методи електроосмосу мають велике практичне застосування для концентрування колоїдних систем, зневоднення пористих матеріалів, осушення грунтів, будівельних конструкцій.
Виникнення потенціалів протікання і седиментації є причинами пожеж і вибухів танкерів, нафтосховищ, нафтопроводів, технологічних комунікацій, виникнення блискавок і грозових розрядів.
Оптичні властивості дисперсних систем і розчинів ВМС. При розповсюдженні світла в деякому середовищі відбуваються такі явища, як заломлення, поглинання, відбиття і розсіювання світла. Оптичні явища надзвичайно важливі для вивчення дисперсних систем. Їх використання дає змогу досліджувати будову і властивості колоїдних часточок і їх угрупувань, визначати концентрацію, вплив різних факторів на взаємодію променів світла з часточками дисперсних систем.
Розсіювання світла характерно для дисперсних систем, коли лінійні розміри часточок менші за довжину хвилі падаючого світла. В цьому випадку спостерігається дифракція – світлові хвилі огинають часточки і змінюють свій початковий напрям руху. Внаслідок дифракції в мікронеоднорідному середовищі дисперсної системи відбувається матове (блакитне) світіння (опалесценція). Цим пояснюється явище – конус Тіндаля (ефект Фарадея-Тіндаля) при якому промінь світла в дисперсній системі стає видимим.
Найбільш простішим випадком є розсіювання світла при виконанні наступних умов:
а) найбільший розмір часточок (r) значно менше довжини хвилі падаючого світла (λ), тобто:
η = λ /10;
б) часточки не поглинають світло (не забарвлені);
в) часточки оптично ізотропні;
г) концентрація часточок мала – відстань між часточками велика порівняно з довжиною хвилі падаючого світла;
д) часточки не проводять електричний струм;
е) об’єм дисперсної системи дуже малий, що дозволяє нехтувати вторинним розсіюванням розсіяного світла.
За Д.Релеем (1871р.), якщо на часточку падає поляризоване світло, то загальна кількість світлової енергії, що розсіюється одиницею об’єму дисперсної системи (ІР) дорівнює:
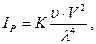 (6.17)
(6.17)
де 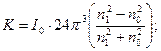
І0 – інтенсивність падаючого світла;  - число часточок в одиниці об’єму; V – об’єм однієї часточки; λ - довжина хвилі падаючого світла; n1 і n2 – показники заломлення дисперсної фази і дисперсійного середовища.
- число часточок в одиниці об’єму; V – об’єм однієї часточки; λ - довжина хвилі падаючого світла; n1 і n2 – показники заломлення дисперсної фази і дисперсійного середовища.
За допомогою рівняння Релея визначають об’єм, радіус і концентрацію часточок дисперсної системи.
З наведеного рівняння Релея випливає, що якщо n1 = n2, світло системою не розсіюється.
За стаціонарних умов вимірювання величини n1, n0 і λ є сталими, тоді рівняння (6.17) спрощується:
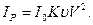 (6.18)
(6.18)
Рівняння Релея застосовується тільки для систем, розмір часточок яких не більше 0,1 частини довжини світлової хвилі. Якщо часточки мають більші розміри, то величина світлорозсіювання змінюється обернено пропорційно вже не в четвертій, а меншій степені довжини хвилі світла. Це сприяє світлорозсіюванню. При розмірах часточок, що значно перевищують довжину світлової хвилі, світлорозсіювання переходить у відбиття, яке не залежить від довжини хвилі.
При проходженні променя білого світла через дисперсну систему в більшій мірі розсіюються більш короткі хвилі, тобто синьо-фіолетової частини спектру. Так, розсіювання найбільш короткохвильової частини сонячного світла на флуктуаціях густини земної атмосфери надає небу вдень голубого кольору, а при сході і заході сонця – червоного. Це стає тому, що їх спостереження відбувається через нижні шари атмосфери, що містять значного розміру часточки пилу і диму. Цей ефект особливо підсилюється при вітряній погоді, коли концентрація часточок збільшується.
Зменшення інтенсивності світла dI при проходженні крізь шар чистої речовини, згідно із законом Ламберта, пропорційне інтенсивності світла І і товщині шару dl:
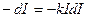 (6.19)
(6.19)
або після перетворень
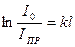 або ІПР = І0 . е-kl, (6.20)
або ІПР = І0 . е-kl, (6.20)
де І0 і ІПР – інтенсивність падаючого світла і яке пройшло крізь систему; k – коефіцієнт екстинкції (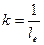 , м-1); 1е – товщина шару речовини, що ослаблює інтенсивність світла в е разів – середня глибина проникнення світла.
, м-1); 1е – товщина шару речовини, що ослаблює інтенсивність світла в е разів – середня глибина проникнення світла.
У випадку розчинів речовин світлопоглинання збільшується зі збільшенням концентрації (закон Ламберта-Бера):
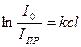 або ІПР = І0 . е-kl, (6.21)
або ІПР = І0 . е-kl, (6.21)
де с – концентрація речовини.
Закон Ламберта-Бера дійсний тільки для відносно тонких шарів розбавлених розчинів.
Сумарне розсіювання розчинами високомолекулярних сполук при освітленні системи неполяризованим світлом описується рівнянням Релея у вигляді:
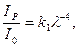 (6.22)
(6.22)
де 
Відношення ІР/I0 називається каламутністю системи 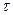 , яку визначають за виміряними значеннями оптичної густини D:
, яку визначають за виміряними значеннями оптичної густини D:
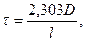 (6.23)
(6.23)
де D = lg I0/IПР; 1 – товщина шару розчину, крізь який проходить світло.
Для розчинів ВМС з часточками, розмір яких перебуває в межах 0,1λ<d<0,3λ рівняння (6.22) треба записати так:
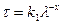 або (6.24)
або (6.24)
 (6.25)
(6.25)
де х – величина, яка є функцією розміру часточок.
Величину х визначають як тангенс кута нахилу прямої в координатах рівняння (6.24) або (6.25) у логарифмічній формі:
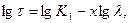 (6.26)
(6.26)
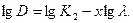 (6.27)
(6.27)
За знайденою величиною х визначають розміри часточок.
Розмір часточок можна визначити спостерігаючи їх в ультрамікроскопі при бічному освітленні. В геометричному об’ємі:
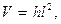
де 1 – сторона квадрата, яку визначають за допомогою окуляра-мікрометра, розчин з масовою концентрацією дисперсної фази С і кількістю часточок в об'ємі n при густині речовини дисперсної фази ρ має розмір часточок d, який розраховується за рівнянням:
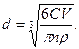 (6.28)
(6.28)
Явище розсіювання світла використовують в оптичних методах вивчення колоїдних систем, визначення концентрації золів, розмірів колоїдних часточок, з метою світломаскування, світлової сигналізації, визначення молекулярних мас високомолекулярних сполук, тощо.
Стійкість дисперсних систем та розчинів ВМС. Ліофобні, тобто термодинамічно нерівноважні дисперсні системи мають нахил до процесів, що ведуть до зміни їх будови – дисперсності, характеру розподілу часточок за розміром в об’ємі дисперсійного середовища. За поглядами М.Пескова розрізняють седиментаційну і агрегативну стійкість дисперсних систем.
Седиментаційна стійкість – це стійкість системи проти зниження потенціальної енергії часточок дисперсної фази при їх осіданні під дією сил тяжіння.
Агрегативна стійкість – це здатність системи протидіяти процесам, які ведуть до зменшення вільної енергії поверхні поділу часточок дисперсної фази з дисперсійним середовищем.
Процесами руйнування дисперсних систем є ізотермічна перегонка (кристалізація) речовини від малих часточок до більш крупних, коалесценція (зливання часточок) і коагуляція (агрегування часточок при їх злипанні).
Роль процесів ізотермічної перегонки, коалесценції і коагуляції в порушенні агрегативної стійкості дисперсних систем різна, поперед всього, в залежності від фазового стану дисперсійного середовища. Коалесценція, коагуляція і седиментаційний розподіл властиві системам з легкорухомим (рідким або газоподібним) дисперсійним середовищем.
Природа стійкості дисперсних систем і умови протікання різних процесів їх руйнування суттєво залежать від концентрації дисперсної фази, характеру взаємодії часточок одна з одною і т.д. Найбільш нестійкими є гідрофобні колоїдні системи, для яких характерна слабка взаємодія між часточками дисперсної фази і дисперсійного середовища. Вони на відміну від гомогенних систем мають великий запас вільної поверхневої енергії, зменшення якої відбувається внаслідок зменшення поверхні поділу фаз. Це призводить до злипання часточок, тому коагуляція є термодинамічно вигідним і довільним процесом. Стабілізація таких систем обумовлена наданням певних факторів стійкості.
У реальних умовах в дисперсних системах одночасно діють декілька факторів. Це термодинамічні (ентропійний, електростатичний, адсорбційно-сольвативний) та кінетичні (гідродинамічний, структуро-механічний). Домінуючими з них є два фактори: адсорбційно-сольвативний та електростатичний.
Адсорбційно-сольвативні процеси сприяють зменшенню міжфазового поверхневого натягу та енергії Гіббса поверхні поділу фаз.
Електростатичний фактор обумовлений створенням електростатичних сил відштовхування, які зростають зі збільшенням потенціалу поверхні часточок 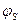 і особливо електрокінетичного
і особливо електрокінетичного 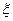 -потенціалу.
-потенціалу.
Іншим фактором стабілізації є процеси ліофілізації. Самовільне утворення ліофільних колоїдних систем обумовлено приростом вільної поверхневої енергії, який при диспергуванні макрофаги компенсується виграшем вільної енергії внаслідок збільшення ентропії за рахунок включення відокремлених часточок у броунівськи рух. Так, наприклад, природні глини при змочуванні водою внаслідок інтенсивної сольватації розпадаються на окремі часточки і утворюють агрегативно стійкі системи.
Ліофілізація особливо характерна для систем, які містять міцелоутворюючі ПАР та ВМС. При утворенні цих систем вільна енергія Гіббса зменшується (ΔG<0).
Агрегативна і седиментаційна стійкості дисперсних систем взаємопов’язані. Доки колоїдна система зберігає агрегативну стійкість, вона стійка і седиментаційно. Порушення агрегативної стійкості призводить до коагуляції системи. З часом, якщо в системі при агрегуванні утворюються досить великі угрупування, то система втрачає седиментаційну стійкість, відбувається розділення фаз дисперсної системи і утворюється осад.
Утворення під час коагуляції крупних агрегатів не завжди призводить до утворення осаду. Причиною цього є так звана конденсаційна (фазова) стійкість дисперсних систем, яка пов’язана з структурою та міцністю агрегатів, що утворюються під час коагуляції системи.
За фазовою стійскістю дисперсійні системи поділяються на конденсаційно стійкі і конденсаційно нестійкі системи.
Конденсаційно стійкі системи утворюють при коагуляції нестійкі агрегати, які перетворюються в пухкий осад. Частинки такого осаду втрачають свою індивідуальність і рухомість, але, внаслідок наявності між агрегатами тонких прошарків рідини, зберігаються як окремі утворення досить довгий час. При певних умовах такі агрегати можуть знову розпадатись на окремі часточки, тобто відбувається їх пептизація.
В конденсаційно нестійких системах утворення агрегатів характеризуються міцною структурою, яка обумовлена наявністю в них безпосередніх фазових контактів у вигляді кристалізаційних містків, зрощування частинок. Такі структури є необоротними і утворюють щільні, кристалічні осади.
Коагуляція дисперсних систем може бути зумовлена різними зовнішніми впливами: додаванням електролітів, струшенням, механічним перемішуванням, підвищенням температури або заморожуванням, дією ультразвукового поля, йонізуючих випромінювань, електролізом тощо.
Найбільш ефективним фактором, що викликає коагуляцію гідрофобних золів є дія електролітів. Вони дуже швидко і різко нейтралізують і стискують подвійний електричний шар міцел, що порушує агрегативну стійкість системи.
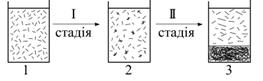
Коагуляція гідрофобних золів здійснюється постадійно. На першій стадії коагуляції, яку називають прихованою, часточки дисперсної фази наближуються одна до іншої і взаємно фіксуються (зчеплюються), утворюючі агрегати з декількох часточок між якими містяться прошарки дисперсійного середовища (рис.6.20).
|
| Рис.6.20. Стадії коагуляції золів: 1 – стійка дисперсна система; 2 – прихована коагуляція; 3- наявна коагуляція (седиментація) |
На другій стадії коагуляції, яку називають наявною, відбувається більш глибокий процес: прошарки середовища в агрегаті стискуються і між часточками утворюється безпосередній контакт. Структура таких агрегатів стає міцною внаслідок кристалізації і зрощування часточок. Тверді агрегати під дією гравітаційних сил тяжіння осідають утворюючі осад. У системах з рідкою чи газоподібною дисперсною системою на цій стадії відбувається повне злиття часточок (коалесценція).
Коагуляція під дією електролітів. Досліджуючи коагуляцію Шульце і Гарді встановили (1882-1900 р.р.), що коагуляцію викликає не вся молекула електроліту, а лише йон–коагулятор. Йон-коагулятор завжди має заряд протилежний заряду колоїдної гранули.
Згідно з правилом Шульце-Гарді (правило валентності), коагулююча дія йона-коагулятора зростає зі зростанням заряду йона.
Мінімальна концентрація електроліту, що зумовлює повну коагуляцію колоїдної системи називається порогом коагуляції (ПК) і виражається в ммоль/л. Поріг коагуляції обернено пропорційний заряду коагулюючих йонів у шостому степені (закон шостого степеня Дерягіна):
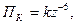 (6.29)
(6.29)
де z – заряд йона, що зумовлює коагуляцію.
Критична концентрація йона-коагулятора СК для тривалентного і двовалентного йонів у сотні і в десятки разів менша ніж для одновалентного:
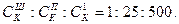
Величину, обернену порогу коагуляції, називають коагулюючою здатністю (об’єм колоїдної системи, що скоагульована 1ммолем йона-коагулятора) і позначають VК:
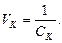 (6.30)
(6.30)
Підвищена коагулюючи здатність йона-когулятора зі збільшенням його заряду пояснюється більш сильним ефектом стиснення подвійного електричного шару колоїдної часточки.
Ефект стиснення ПЕШ у ряда йонів з однаковим зарядом залежить від радіуса сольватованого йона:
Li+ < Na+ < K+ < Rb+ < Cs+; Mg2+ < Ca2+ < Cr2+ <Ba2+;
Cl- < Br - < NO3- < J- < CNS -.
Їх коагулююча активність збільшується зі зменшенням радіуса. Це стосується неорганічних сполук. У випадку органічних йонів їх коагулююча дія зростає зі збільшенням адсорбційної здатності.
Згідно з правилом Траубе для органічних електролітів, які містять карбонвмісні ланцюги різної довжини, коагулюючи здатність рівномірно збільшується зі зростанням СН2 -груп.

|
| Рис.6.21. Схема утворення тонкої плівки рідини (2) при наближенні двох об’ємів фази (1) |
Теорія стійкості і коагуляції дисперсних систем. Сучасну теорію стійкості колоїдних систем розробили Б.Дерюгін, Л.Ландау, Е.Вервей, Я.Овербек (1937-1991 р.р.), яку називають теорією ДЛФО. Згідно з теорією ДЛФО при наближенні двох сферичних часточок однакового радіуса r на відстань між їх центрами R у мінімальній ширині щілини h=R-2r виникає розклинювальний тиск рідини II (рис.6.21, а).
Розклинювальний тиск розглядають як надлишковий (порівняно з об’ємами фаз 1 і 2) (рис.6.21, б) тиск, який діє з боку прошарку на поверхні, що обмежують його, і намагається розсунути („розклинити”) їх. Цей тиск визначається молекулярними силами притягання і електростатичними силами відштовхування.
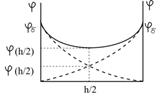
Для визначення електростатичної складової розклинювального тиску розглянемо розподіл потенціалу в прошарку між двома паралельними однойменно зарядженими поверхнями. В достатньо розбавленому розчині електроліту біля зарядженої поверхні потенціал падає від значення  (на межі адсорбційного шару) до нуля на нескінченно великій відстані від неї (пунктирні криві на рис.6.22). При зближенні заряджених поверхонь до відстані, яка відповідає товщині йонної атмосфери
(на межі адсорбційного шару) до нуля на нескінченно великій відстані від неї (пунктирні криві на рис.6.22). При зближенні заряджених поверхонь до відстані, яка відповідає товщині йонної атмосфери  , відбувається зміна розподілу потенціалу в прошарку між поверхнями, і в середині прошарку з’являється мінімум потенціалу (суцільна крива на рис.6.22). Потенціал в середині прошарку
, відбувається зміна розподілу потенціалу в прошарку між поверхнями, і в середині прошарку з’являється мінімум потенціалу (суцільна крива на рис.6.22). Потенціал в середині прошарку 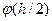 дорівнює подвійному значенню потенціалу одиничного дифузного шару на тій же відстані h/2 від поверхні
дорівнює подвійному значенню потенціалу одиничного дифузного шару на тій же відстані h/2 від поверхні  :
:
 . (6.31)
. (6.31)
|
Рис.6.22. Зміна потенціалу  в прошарку рідини
між поверхнями заряджених часточок в прошарку рідини
між поверхнями заряджених часточок
|
В підсумку електролітична складова розклинювального тиску може бути наближено виражена наступним чином:
 , (6.32)
, (6.32)
де с – концентрація йонів у розчині; R – газова стала; Т – абсолютна температура; γ - стала, яка визначається потенціалом поверхні 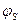 ; h – відстань між часточками;
; h – відстань між часточками; 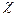 - величина, обернена товщині дифузного шару, що включає в себе концентрацію електроліту; е – основа натурального логарифму.
- величина, обернена товщині дифузного шару, що включає в себе концентрацію електроліту; е – основа натурального логарифму.
Сили притягання – це сили Ван-дер-Ваальса, які складаються із сил дисперсійної, орієнтаційної та індукційної взаємодії. Роль дисперсійної взаємодії особливо суттєва в дисперсних системах, де кожна часточка представляє собою мікрооб’єм конденсованої фази, розміри якого великі порівняно з молекулярними. В цьому випадку вже на помітних відстанях відбувається часткова компенсація дисперсійної взаємодії, тобто часткове „насичення” поверхневих сил.
Для двох часточок з тонким плоским прошарком рідини товщиною h, енергія молекулярного притягання описується виразом:
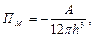 (6.33)
(6.33)
де А – константа Гамакера.
Від’ємний знак розклинювального тиску свідчить про намагання фаз до наближення під дією сил молекулярного притягання.
Згідно теорії ДЛФО загальний розклинювальний тиск ПЗАГ дорівнює сумі позитивної складової розклинювального тиску Пе (відштовхування) і негативної складової розклинювального тиску ПМ (молекулярного притягання):
ПЗАГ = Пе + ПМ. (6.34)
Оскільки енергія електростатичного відштовхування Uе та молекулярного притягання UМ є функцією від відстані h,то
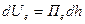 , (6.35)
, (6.35)
 . (6.36)
. (6.36)
Після інтегрування рівнянь енергію взаємодії колоїдних часточок визначають за виразом:
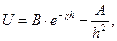 (6.37)
(6.37)
де В – множник, який залежить від значення електричних потенціалів ПЕШ, температури, властивостей середовища, е – основа натурального логарифму; 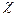 - величина, зворотна товщині дифузного шару; h – відстань між часточками; А – стала Гамакера.
- величина, зворотна товщині дифузного шару; h – відстань між часточками; А – стала Гамакера.
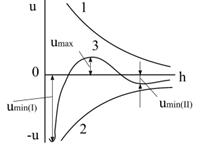
На рис.6.23 показані потенціальні криві взаємодії колоїдних часточок дисперсних систем.
|
| Рис.6.23. Потенціальні криві взаємодії колоїдних часточок: 1 – енергія відштовхування; 2 – енергія притягання; 3 – результуюча крива |
Міжмолекулярні сили притягання між часточками починають виявлятися на великих відстанях. Ця взаємодія за степеневим законом Дерягіна зростає зі зменшенням відстані h (рис.6.23, крива 2). Сили електростатичного відштовхування виникають тільки при перекриванні ПЕШ часточок, що наблизились одна до одної під дією сил притягання. Зі зменшенням відстані між часточками ці сили збільшуються за експоненціальною залежністю (рис.6.23, крива 1).
Результуюча потенціальна крива 3 одержана з перших двох геометричним складанням ординат. На малих відстанях при h  0 сили електростатичного відштовхування постійні, а сили міжмолекулярного притягання максимальні. По мірі зростання відстані h між часточками переважає дія сил міжмолекулярного притягання, а сили електростатичного відштовхування переважають на середніх відстанях. На результуючий кривій спостерігаються два мінімуму. Перший мінімум (І) відповідає безпосередньому контакту і злипанню часточок, а другий мінімум (ІІ) – їх взаємного притяганню у прошарку середовища. На середніх відстанях на кривій спостерігається максимум, який характеризує потенціальний бар’єр, що заважає зближенню часточок. Тобто на цій відстані переважають сили електростатичного відштовхування, які перешкоджають злипанню часточок.
0 сили електростатичного відштовхування постійні, а сили міжмолекулярного притягання максимальні. По мірі зростання відстані h між часточками переважає дія сил міжмолекулярного притягання, а сили електростатичного відштовхування переважають на середніх відстанях. На результуючий кривій спостерігаються два мінімуму. Перший мінімум (І) відповідає безпосередньому контакту і злипанню часточок, а другий мінімум (ІІ) – їх взаємного притяганню у прошарку середовища. На середніх відстанях на кривій спостерігається максимум, який характеризує потенціальний бар’єр, що заважає зближенню часточок. Тобто на цій відстані переважають сили електростатичного відштовхування, які перешкоджають злипанню часточок.
Якщо середня кінетична енергія часточок більша ніж енергія, яка відповідає потенціальному бар’єру, то вони можуть подолати електростатичні сили відштовхування і наблизитися на дуже малу відстань (область мінімуму 1), де превалюють сили притягання, і злипнутися у агрегат. Агрегати, що утворилися, внаслідок розриву сольватних прошарків набувають деяких властивостей твердого тіла, тобто утворюється осад.
Якщо агрегатний бар’єр дуже високий і його колоїдні часточки не можуть подолати, то в такій системі агрегати не утворюються. Це випадок агрегативно стійкої системи.
Другий потенціальний мінімум (ІІ) відповідає взаємодії часточок на далеких відстанях одна від одної. Внаслідок дії сил відштовхування, які не дають часточкам наближатися дуже близько і коли їм заважають розійтися сили притягання, утворюються структуровані системи–гелі. Оскільки енергія взаємного притягання часточок в таких системах досить слабка, то ці структури легко руйнуються при струшуванні, тобто відбувається перехід гелю в золь. Через деякий час золь може знову переходити в гелеподібний стан.
Явище ізотермічного оборотного переходу
Золь L Гель,
що відбувається під впливом механічної дії (перемішування, струшування, вібрації, ультразвуку тощо) називається тиксотропією.
Коагуляція колоїдних систем електролітами відбувається за двома механізмами – концентраційними і нейтралізаційними (адсорбційними).
Концентраційна коагуляція пов’язна зі збільшенням концентрації електроліту, який є індиферентним і не спроможний до специфічної адсорбції. Збільшення концентрації індиферентного електроліту в дисперсній системі призводить до стискування дифузної частини ПЕШ. Внаслідок цього частина протийонів дифузного шару переходить в адсорбційний шар, що стає причиною значного зменшення 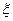 -потенціалу. Одночасно введення електроліту збільшує йонну силу розчину, пригнічує дифузію протийонів і зменшує розпушеність дифузного шару, що є впливовим фактором для колоїдних систем із сильно зарядженими часточками.
-потенціалу. Одночасно введення електроліту збільшує йонну силу розчину, пригнічує дифузію протийонів і зменшує розпушеність дифузного шару, що є впливовим фактором для колоїдних систем із сильно зарядженими часточками.
Нейтралізаційна коагуляція спостерігається в дисперсних системах із слабо зарядженими часточками, які мають низьке значення поверхневого потенціалу. Коагуляцію викликають йони, здатні до специфічної адсорбції на поверхні часточок, і які заряджені протилежно до них. Адсорбуючись, ці йони знижують поверхневий потенціал, паралельно знижується і 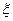 -потенціал, що призводить до наближення і злипання колоїдних часточок. Поріг нейтралізаційної коагуляції обернено пропорційний квадрату величини заряду йона-коагулятора (правило Ейлера-Кофе):
-потенціал, що призводить до наближення і злипання колоїдних часточок. Поріг нейтралізаційної коагуляції обернено пропорційний квадрату величини заряду йона-коагулятора (правило Ейлера-Кофе):
 (6.38)
(6.38)
На рис.6.24 приведені потенціальні криві взаємодії колоїдних часточок при концентраційній і нейтралізаційній коагуляціях.

|
| Рис.6.24. Потенціальні криві взаємодії колоїдних часточок при концентраційній (а) і нейтралізаційній коагуляціях: 1 – результуюча потенціальна криіва за відсутності коагулюючого електроліту; 1’ – при наявності електроліту; 2 – енергія відштовхування за відсутності коагулюючого електроліту; 2’ – при наявності коагулюючого електроліту |
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 1051; Нарушение авторских прав?; Мы поможем в написании вашей работы!