
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 6. Фізико-хімія дисперсних систем та розчинів високомолекулярних сполук 3 страница
|
|
|
|
|
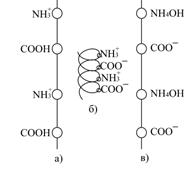
| Рис.6.4. Стан білкової молекули при різних значеннях рН: а – рН < рі; б – рн = рі; в – рН > рі. |
При зміщенні рН від ізоелектричної точки в бік зменшення або збільшення рН однойменно заряджені групи відштовхуються, і молекула білка розпрямляється, набуваючи лінійної форми (рис.6.4, а, в).
Будова ВМС. Будова молекул високополімерів залежить від будови молекул вихідних мономерів. Маромолекули, що утворюються при полімеризації, можуть мати як лінійну, розгалужену, сітчасту, так і більш складну форму (рис.6.5).
Наприклад, молекули целюлози, крохмалю і глікогену складаються з глюкозних залишків (рис.6.5, в), які з’єднуються між собою через атоми Оксигену. Молекула целюлози має лінійну форму будови, а молекули крохмалю і глікогену складаються з розгалужених ланцюгів, а саме – молекула крохмалю має деревоподібну, а глікогену – кущоподібну форму (рис.6.6).
Це пояснюється тим, що у процесі синтезу лінійне розташування ланок у ланцюгу може порушуватися, при цьому утворюються розгалуження. До утворення просторових або зшитих структур приводить введення природних або спеціальних домішків хімічно активних низькомолекулярних речовин. Наприклад, природний каучук, який характеризується суворо лінійним розташуванням ланок у ланцюгу, при вулканізації (вводиться Сульфур) набуває зшиту структуру.
В макромолекулі полімеру ланки ланцюга сполучені між собою хімічними зв’язками, які навіть при незначному збільшенні відстані між сусідніми атомами Карбону різко послаблюються. Тому під впливом теплового руху взаємне розташування атомів Карбону може змінюватись. Завдяки цьому макромолекула може набувати різноманітних конформацій, тобто гнучкості.
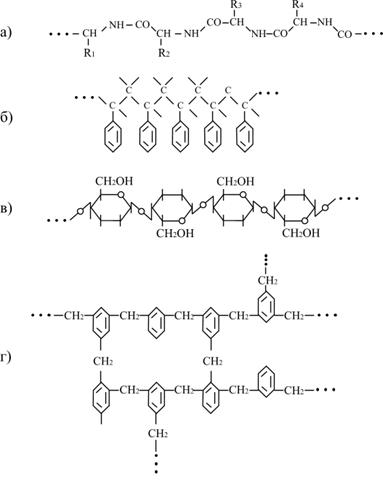
|
| Рис.6.5. Структура ланцюгів високополімерів: а – поліпептиду; б – полістиролу; в – целюлози; г - резиту |
Дуже гнучкі макромолекули прагнуть набути енергетично вигідну сферичну форму і утворювати глобули (рис.6.7, а). Глобули можуть утворюватися з одиничної макромолекули, або з кількох макромолекул (рис.6.7, б, в).
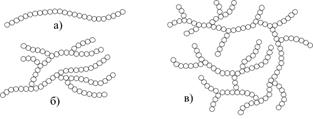
|
| Рис.6.6. Схема зображення макромолекул: а – целюлози; б – крохмалю; в - глікогену |
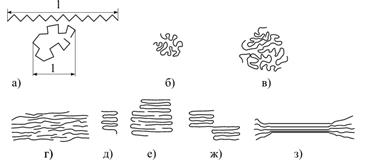
|
| Рис.6.7. Надмолекулярні структури полімерів: а – макромолекула розтягнута і згорнута в клубок; б- глобула з одиничної макромолекули; в – глобула з кількох макромолекул; г – пачкове утворення; д –макромолекула згорнута у пачку; е – пачка з кількох макромолекул; ж – схема входження макромолекули одночасно в дві пачки; з - фібрила |
Макромолекули можуть складатися у пачки (рис.6.7, г, д, е, ж) утворювати великі і сильно витягнуті агрегати-фібрили (рис.6.7, з). Пластинчасті і голкоподібні структури полімерів можуть утворювати більш складніші і досконаліші структури-сфероліти і навіть монокристали.
Властивості розчинів ВМС. Особливість розчинення ВМС полягає у тому, що розчинність полімерів можлива лише у тих розчинниках, до яких вони ліофільні, тобто гідрофільні полімери розчиняються у воді та інших полярних розчинниках, а гідрофобні полімери – у вуглеводнях. Так, желатина розчиняється у воді, а каучук – у бензені.
Якщо полярність розчинника не співпадає з полярністю ВМС, в цьому випадку при розчиненні утворюються колоїдні розчини, а споріднені ВМС і розчинник утворюють істинні розчини. Наприклад, розчин каніфолі у воді є істинним розчином, а якщо до цього розчину додати спирту – утворюється колоїдний розчин (дисперсія каніфолі у спирті).
Розчиненню полімеру передує набухання, тобто проникнення розчинника в порожнині полімеру. При цьому збільшуються маса і об’єм зразка полімеру (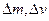 ).
).
Кінетика процесу набухання зразка полімеру приведена на рис.6.8. Кінетичні криві описують три стадії набухання: початкову (обмежену) стадію набухання (крива 1), подальшу стадію набухання з частковим розчиненням зразка полімеру (крива 2) і стадію необмеженого набухання з повним розчиненням зразка полімеру при якому макромолекули полімеру переходять у розчин. Ступінь набухання (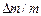 ) при цьому набуває від’ємного значення (крива 3).
) при цьому набуває від’ємного значення (крива 3).

|
| Рис.6.8. Кінетика набухання полімеру: 1 – обмежене набухання; 2 – набухання з обмеженим розчиненням; 3 – необмежене набухання (повне розчинення) |
Набухання і розчинення ВМС – самовільний процес, що відбувається при зменшенні енергії Гіббса (ΔG<0). На процес впливають такі фактори: в’язкість розчинника, молекулярна маса полімеру, його надмолекулярна структура, температура розчинення. Велике значення має хімічна природа полімеру і розчинника. Так, набуханню і розчиненню сприяє утворення гідрогенних зв’язків між полярними групами полімеру і розчинника.
Підвищення в’язкості розчинника зменшує швидкість проникнення рідини в полімер, а це значно сповільнює процес набухання. Навпаки підвищення температури прискорює процеси набухання і розчинення.
Істотно впливає на процес розчинення зростання молекулярної маси полімеру. Більша довжина макромолекули потребує більшої витрати енергії на розрив усіх зв’язків в макромолекулі, тому розчинність зменшується.
Надмолекулярна структура високополімерів також значно впливає на процеси набухання і розчинення ВМС. Так, у щільно згорнуті полімерні клубки альбуміну білків, глікогену молекули розчинника дуже важко проникають, тому такі глобулярні полімери практично не набухають.
В той же час, якщо глобули полімерів мають велику спорідненість до розчинника, їх взаємодія послаблює зв’язки між окремими глобулами і вони переходять у розчин.
Гірше і важче набухають і розчиняються полімери з розгалуженими мікромолекулами і кристалічні полімери. Перші мають між макромолекулами поперечні зшивки, які значно зменшують проникнення розчинника і повністю виключають можливість розчинення полімеру. Другі взаємодіють з розчинником лише поверхнею контакту, що обмежує набухання і розчинення кристалічного полімеру.
|
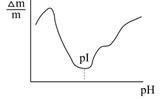
| Рис.6.9. Вплив рН на ступінь набухання білків |
Набухання поліелектролітів у воді в значній мірі залежить від стану окремих ланок молекули білка. В ізоелектричній точці білка (рІ) протилежно заряджені групи –NH3+ та –СОО- притягуються і молекула білка закручується у спіраль (згортається). Проникнення розчинника у макромолекулу зменшується, тому в ізоелектричній точці набухання мінімальне. При зміні рН в кислий або лужний бік від ізоелектричної точки однойменно заряджені групи відштовхуються, і молекула білка розпрямляється, що призводить до зростання набухання. Залежність ступеню набухання білків від рН приведена на рис.6.9.
Добування і властивості дисперсних систем і розчинів ВМС. Виникнення дисперсної системи в результаті утворення частинок нової стабільної фази в метастабільної системі може бути викликана як відхиленням в хімічному складі фаз, так і за рахунок фізико-хімічного впливу на систему. Це в першу чергу різні хімічні реакції, які приводять до виникнення високих концентрацій малорозчинних сполук, що обумовлює пересичення в системі, а також зміна тиску, температури і складу фаз.
Процеси утворення дисперсних систем різної дисперсності і концентрації широко розповсюджені в природі і використовуються в різних областях технології. Так, окисно-відновні реакції лежать в основі багатьох методів добування золів, наприклад,
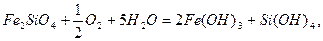
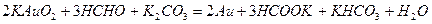
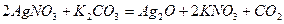
Важливе значення мають утворення гідрозолей в процесах гідролізу солей.
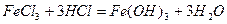
хімічна, або дисолюційна пептизація:
Fe(OH)3 + HCl L FeOCl + 2H2O,
обмінні реакції:
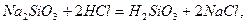
які можуть застосовуватися для добування дисперсних систем.
Метод пептизації полягає у дезагрегації частинок осаду розпушеної структури, між якими є прошарок дисперсійного середовища. За механізмом пептизація поділяється на дисолюційну, адсорбційну і пептизацію промиванням розчинника (дисперсійним середовищем).
Адсорбційна пептизація – це вибіркова адсорбція на осаді йонів, електролітів, що додаються до осадів.
При хімічній, або дисолюційної пептизації речовини, що додаються до осадів, вступають в реакцію з поверхнею осадів.
Промивання осадів розчинником або дисперсійним середовищем, створює вимивання надлишку електроліту і утворюється стійкий золь. Пептизація може відбуватися при додаванні до осаду неелектролітів, молекули яких адсорбуються на частинках осаду і запобігають їх злипанню. Такими речовинами є органічні кислоти, багатоатомні спирти, тощо.
Для одержання колоїдних розчинів велике практичне значення мають методи диспергування, що грунтуються на подрібненні великих частинок до колоїдного стану. Процеси диспергування потребують великих енергетичних витрат. Для добування високодисперсних систем використовують колоїдні млини.
Важливу роль в інтенсифікації процесів диспергування грає введення поверхнево-активних середовищ, що значно зменшує енергетичні витрати на ці процеси.
Високодисперсні золі металів і сплавів у самих різних дисперсійних середовищах можуть бути одержані методом електророзпорушення, механічним або акустичним диспергуванням.
Електричні явища. Завдяки надлишку поверхневої енергії, якою володіють дисперговані часточки, на межі розділу фаз на міжфазових поверхнях виникає взаємодія, що приводить до утворення подвійного електричного шару (ПЕШ).
Просторове розділення зарядів і утворення ПЕШ характерно для любої межі двох фаз, в системі якої є йони і інші заряджені частинки. Причиною утворення ПЕШ і відповідного стрибка потенціалу можуть бути:
а) обмін зарядженими частинками;
б) вибіркова адсорбція йонів;
в) адсорбція полярних молекул.
Знак заряду поверхні частинок залежить від природи дисперсної фази та дисперсійного середовища. При змочуванні водою поверхня таких речовин, як метали, сульфіди металів, силікагель, крохмаль, деревина, папір, гуміарабік тощо заряджається негативно, а нерозчинних оксидів, гідроксидів металів, деяких солей – позитивно.
На знак заряду поверхні частинок значно впливає значення діелектричної проникності. З двох спряжених фаз позитивно заряджається фаза з більшою діелектричною проникністю, наприклад, частинки глини у воді заряджені негативно, а вода – позитивно.
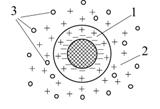
Подвійний електричний шар складається з двох частин: щільної (внутрішня обкладка) і дифузної (зовнішня обкладка((рис.6.10). Більш близька до поверхні внутрішня обкладка ПЕШ (шар Штерна-Гельмгольца) відповідає частині, де адсорбційні сили суттєві. У більш віддаленій дифузній частині (шар Гуї-Чепмена) ними можна знехтувати.
|
| Рис.6.10. Схематична будова подвійного електричного шару: 1 – внутрішня обкладка (адсорбційний шар); 2 – зовнішня обкладка (дифузний шар); 3 – молекули дисперсійного середовища |
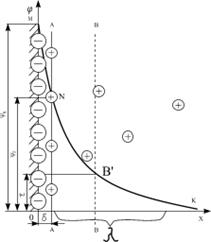
Внутрішня обкладинка представляє собою адсорбційний монойонний шар, товщиною не менше двох радіусів йонів (б) (рис.6.11). За Штерном в неї знаходяться потенціаловизначаючі йони, фіксовані твердою поверхнею і частина протийонів адсорбційного шару.
Зовнішня обкладинка складається з протийонів дифузного шару. Її товщина (λ) може бути значною і залежить від властивостей і складу дисперсної системи. Розрахувати її можна за рівнянням:
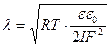 , (6.6)
, (6.6)
де 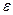 - діелектрична проникність дисперсійного середовища;
- діелектрична проникність дисперсійного середовища; 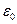 - діелектрична стала; І – йонна сила розчину; F – число Фарадея.
- діелектрична стала; І – йонна сила розчину; F – число Фарадея.
На межі твердої та рідкої фаз виникає так званий поверхневий, або 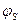 -потенціал. Величина
-потенціал. Величина 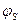 - потенціалу пропорційна числу заряджених йонів твердої поверхні (ядра), а його знак збігається зі знаком потенціаловизначаючих йонів.
- потенціалу пропорційна числу заряджених йонів твердої поверхні (ядра), а його знак збігається зі знаком потенціаловизначаючих йонів.
На межі адсорбційного і дифузного шарів (лінія АА) виникає стрибок потенціалу, який Штерн назвав  - потенціалом, або адсорбційним потенціалом. Потенціал у адсорбційному шарі зменшується лінійно (пряма MN) від
- потенціалом, або адсорбційним потенціалом. Потенціал у адсорбційному шарі зменшується лінійно (пряма MN) від 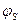 до
до  .
.
|
Рис.6.11. Схема будови подвійного електричного шару за Штерном: 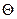 - потенціаловизначаючі йони; - потенціаловизначаючі йони; 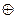 - протийони; заштрихована частина – агрегат - протийони; заштрихована частина – агрегат
|
Заряд адсорбційного шару складається із зарядів йонів, що адсорбуються як за рахунок електростатичного адсорбційного потенціалу, так і за рахунок потенціалу специфічної адсорбції.
У дифузному шарі протийони розподілені нерівномірно, тому потенціал у дифузній частині ПЕШ змінюється за експоненціальним законом Больцмана (крива NK) від значення  наближуючись до нуля:
наближуючись до нуля:
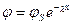 , (6.7)
, (6.7)
де - 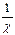 - ефективна товщина дифузного шару (відстань на який
- ефективна товщина дифузного шару (відстань на який  - потенціал зменшується в е разів); х – відстань від межі шару Штерна в глибину рідкої фази.
- потенціал зменшується в е разів); х – відстань від межі шару Штерна в глибину рідкої фази.
Товщина ПЕШ залежить від йонної сили розчину (І):
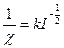 . (6.8)
. (6.8)
Згідно теорії сильних електролітів Дебая-Гюккеля з підвищенням концентрації електролітів у рідині і зарядоутворюючих їх йонів товщина ПЕШ зменшується.
Важливим потенціалом, який характеризує ПЕШ є електрокінетичний потенціал, або 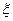 (дзета)-потенціал.
(дзета)-потенціал. 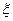 -потенціал виникає на межі сковзання (лінія ВВ). Межа сковзання – це межа між часточками, здатними до руху в електричному полі, та оточуючою її рідиною. Електрокінетичний потенціал розраховують за експериментальними даними за рівнянням Гельмгольца-Смолуховського:
-потенціал виникає на межі сковзання (лінія ВВ). Межа сковзання – це межа між часточками, здатними до руху в електричному полі, та оточуючою її рідиною. Електрокінетичний потенціал розраховують за експериментальними даними за рівнянням Гельмгольца-Смолуховського:
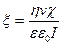 , (6.9)
, (6.9)
де η - в'язкість середовища; 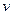 - об’ємна швидкість руху середовища;
- об’ємна швидкість руху середовища; 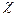 - питома електропровідність;
- питома електропровідність; 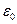 - діелектрична стала (8,854 . 10-12 ф/м);
- діелектрична стала (8,854 . 10-12 ф/м); 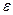 - діелектрична проникність середовища; І – сила струму.
- діелектрична проникність середовища; І – сила струму.
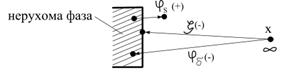
|
| Рис.6.12. Схема, що ілюструє термодинаміку потенціалів |
З точки зору термодинаміки  - потенціал дорівнює роботі переносу одиниці позитивного заряду з глибини даної фази в точку, що розташована у безпосередній близкості від поверхні даної фази (10-6 м) (рис.6.12).
- потенціал дорівнює роботі переносу одиниці позитивного заряду з глибини даної фази в точку, що розташована у безпосередній близкості від поверхні даної фази (10-6 м) (рис.6.12).
Термодинамічно 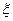 -потенціал відповідає роботі, яка відповідає переносу одиничного заряду з нескінченно віддаленої точки об’єму рідкої фази з потенціалом, рівним нулю, на межу сковзання з потенціалом
-потенціал відповідає роботі, яка відповідає переносу одиничного заряду з нескінченно віддаленої точки об’єму рідкої фази з потенціалом, рівним нулю, на межу сковзання з потенціалом 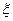 .
.
Величина електрокінетичного потенціалу залежить від концентрації електролітів, що присутні у розчині, а також від валентності йонів, особливо, протийонів. Збільшення концентрації йонів у розчині призводить до стискання дифузного шару до товщини 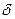 і зменшенню
і зменшенню 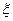 -потенціалу до нуля. В цьому випадку дисперсна система переходить в ізоелектричний стан.
-потенціалу до нуля. В цьому випадку дисперсна система переходить в ізоелектричний стан.
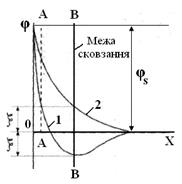
Особливо великий вплив на 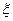 -потенціал виявляють органічні катіони, гідрогенйони, ряд деяких йонів, які не тільки здатні дуже знизити величину електрокінетичного потенціалу, але й викликати зміну його знаку. Це явище називають перезарядкою. На рис.6.13 зображена схема, яка пояснює зміну знаку
-потенціал виявляють органічні катіони, гідрогенйони, ряд деяких йонів, які не тільки здатні дуже знизити величину електрокінетичного потенціалу, але й викликати зміну його знаку. Це явище називають перезарядкою. На рис.6.13 зображена схема, яка пояснює зміну знаку 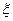 -потенціалу. Крива 1 зміни потенціалу до перезарядки відсікає на межі сковзання відрізок, який відповідає величині позитивного
-потенціалу. Крива 1 зміни потенціалу до перезарядки відсікає на межі сковзання відрізок, який відповідає величині позитивного 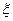 -потенціалу. Крива 2 падіння потенціалу відсікає на межі сковзання відрізок, який розташований під віссю абсцис, що вказує на надлишок в адсорбційному шарі протийонів. Це відповідає негативному значенню
-потенціалу. Крива 2 падіння потенціалу відсікає на межі сковзання відрізок, який розташований під віссю абсцис, що вказує на надлишок в адсорбційному шарі протийонів. Це відповідає негативному значенню 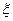 -потенціалу.
-потенціалу.
|
Рис.6.13. Схема зміни знаку 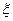 -потенціалу: 1 – зміна потенціалу
до перезарядки; 2 – крива падіння потенціалу -потенціалу: 1 – зміна потенціалу
до перезарядки; 2 – крива падіння потенціалу
|
Зниження концентрації колоїдного розчину при розбавленні призводить до десорбції потенціаловизначаючих йонів, що зменшує значення поверхневого 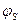 - потенціалу. При розведенні колоїдного розчину значення
- потенціалу. При розведенні колоїдного розчину значення 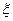 - потенціалу збільшується, але зменшення
- потенціалу збільшується, але зменшення 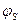 -потенціалу призводить і до зменшення
-потенціалу призводить і до зменшення 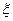 -потенціалу. Аналогічно впливає підвищення температури: збільшується товщина дифузного шару, але одночасно зменшується
-потенціалу. Аналогічно впливає підвищення температури: збільшується товщина дифузного шару, але одночасно зменшується 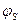 - потенціал зі зростанням десорбції потенціаловизначаючих йонів.
- потенціал зі зростанням десорбції потенціаловизначаючих йонів.
Будова міцел. Розглянемо будову колоїдних часточок ліофобних золів на прикладі золю силікатної кислоти. Згідно з міцелярною теорією будови колоїдних розчинів золь складається з міцел та інтерміцелярної рідини (дисперсійного середовища). Міцела – це часточка дисперсної фази разом з зарядами, які утворюють ПЕШ. Зарядами у даному випадку є йони, які утворюються під час дисоціації і гідролізу речовин:
Na2CO3 L 2Na+ + CO32-,
HCl L H+ + Cl-,
CO32- + HOH L HCO3- + OH-.
В середині міцели утворюється агрегат, який складається з m молекул H2SiO3. Згідно з правилом Панета-Фаянса, йони SiO32- адсорбуються на поверхні агрегату, утворюючи шар потенціалвизначаючих йонів, які, в свою чергу, наближують (притягають) до себе частину протийонів х . Н+. Агрегат разом з адсорбованими на ньому потенціаловизначаючими йонами називається ядром міцели. Ядро і адсорбований шар протийонів складають колоїдну часточку або гранулу. Колоїдна часточка має величину заряду, який складається з суми потенціловизначаючих йонів і протийонів адсорбційного шару. Знак заряду колоїдної часточки завжди такий самий, який має потенціаловизначаючий йон. Заряд гранули компенсується зарядами йонів протилежного знаку дифузного шару, тому в цілому міцела є електронейтральною часточкою. Отже, у міцели розрізняють агрегат, ядро, адсорбційний шар, колоїдну часточку і дифузний шар протийонів:
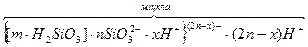
агрегат адсорбційний протийони
шар дифузного
ядро шару
колоїдна часточка (гранула)
Формула міцели може мати і інший вигляд:
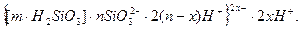
Якщо в якості потенціаловизначаючих йонів будуть йони HSiO3-, формула міцели буде мати вигляд:
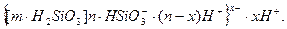
Залежно від того, який з йонів в розчині буде мати більшу концентрацію, будова міцели змінюється. Так, при надлишку в розчині йонів Н+, міцела набуває вигляду:
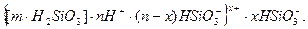
Колоїдні часточки золю силікатної кислоти при агрегації переходять у драглі. Висушені драглі представляють собою часточки, які покриті групами ≡SiOH. Формула міцели таких драглів (силікагелю) має вигляд:
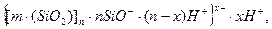
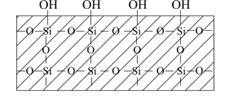
де, nSiO- означає не адсорбовані йони (таких йонів взагалі не існує), а число дисоційованих груп ≡SiOH (рис.6.14).
|
| Рис.6.14. Схема будови гідратованого оксиду силіцію(IV) |
Формули міцел золів Ауруму, Аргентуму, Феруму за реакціями, при яких вони утворюються, мають вигляд:
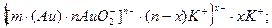
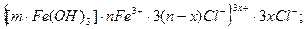
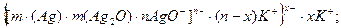
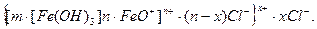
Утворення золю Феруму за методом пептизації промивання розчинником відбувається за схемою:
{[m[Fe(OH)3] . nFe3+]3n+ . 3nCl-}0 L
L {[m[Fe(OH)3] . nFe3+]3+ . 3(n-x)Cl-}3x+. 3xCl-.
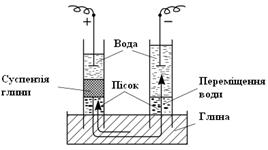
Електрокінетичні явища. Особливі електричні властивості дисперсних систем вперше виявив російський вчений Ф.Рейсс в 1807 р. Встановивши у шматок мокрої глини дві скляні трубки, насипавши потроху піску і заливши трубки чистою водою, він занурив у воду електроди джерела постійного електричного струму (рис.6.15.). При пропусканні електричного струму крізь цю систему Рейсс помітив перенос рідини з анодного в катодний простір, а часточки глини проникали в анодний простір; таке явище отримало назву електрофорезу, або катафорезу.
|
| Рис.6.15. Схема приладу Рейсса |
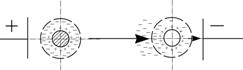
Механізм електрофорезу полягає в тому, що під дією електричного поля ПЕШ йонів розривається на межі сковзання, часточки глини, які мають негативний заряд рухаються до анода, а позитивно заряджені молекули води в протилежний бік до катода (рис.6.16). Явища взаємного переміщення твердої і рідкої фаз під впливом електричного струму називаються електрокінетичними.
|
| Рис.6.16. Схема руху часточок при електрофорезі |
Швидкість електрофорезу залежить від величини  -потенціалу і визначається рівнянням Гельмгольца-Смолуховського:
-потенціалу і визначається рівнянням Гельмгольца-Смолуховського:
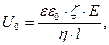 (6.10)
(6.10)
де Е – зовнішня різниця потенціалів; l – віддаль між електродами; U0 – лінійна швидкість руху фаз.
В рівнянні відношення Е/l є градієнтом потенціалу Н, тобто напругою зовнішнього електричного поля:
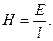
Лінійна швидкість руху часточок U0 змінюється пропорційною напругою зовнішнього електричного поля Н, тому не може служити їх характеристикою. При одиничному градієнті потенціалу (H=1)
 (6.11)
(6.11)
де UЕФ – електрофоретична рухомість.
Електрофоретичну рухомість, яка є характеристикою руху колоїдних часточок, знаходять експериментально за виразом:
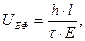 (6.12)
(6.12)
де h – шлях пройдений часточкою за час 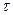 ; l – відстань між електродами; Е – прикладена різниця потенціалів.
; l – відстань між електродами; Е – прикладена різниця потенціалів.
|
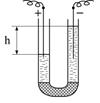
| Рис.6.17. Схема досліду Рейсса з електроосмосу |
В іншому досліді Рейсс дослідив переміщення рідини крізь порувату перегородку з товченого кварцу (рис.6.17) при пропусканні сталого струму. Рівень води в трубці з позитивним електродом знижувався, а з негативним – підвищувався. Рух рідини в трубках відбувався доти, поки не встановлювалась певна різниця рівнів рідини (h – гідростатичний тиск). З цього досліду Рейсс зробив висновок, що при контакті з частинками кварцу рідина заряджається позитивно і це є причиною підняття рівня води в трубці з від’ємно зарядженим електродом. Це явище спрямованого переміщення дисперсійного середовища відносно нерухомої дисперсної фази в постійному електричному полі одержало назву електроосмосу.
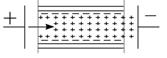
Напрямок переміщення рідини (рис.6.18) вимірювання швидкості її течії дає можливість визначити знак  -потенціалу і розрахувати стрибок потенціалу на межі сковзання.
-потенціалу і розрахувати стрибок потенціалу на межі сковзання.
|
| Рис.6.18. Схема руху рідини в капілярі при електроосмосі |
Швидкість руху дисперсійного середовища, віднесену до одиниці напруженості електричного поля, називають електроосмотичною рухомістю (UЕОР). Її визначають, як:
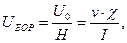 (6.13)
(6.13)
де U0 – лінійна швидкість течії рідини; v – об’ємна швидкість течії рідини (v=VР/ 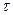 - об’єм переміщеної рідини (VР) за час (
- об’єм переміщеної рідини (VР) за час (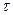 ));
)); 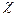 - питома електропровідність; І – сила струму.
- питома електропровідність; І – сила струму.
В цьому випадку величину  -потенціалу обчислюють за рівнянням:
-потенціалу обчислюють за рівнянням:
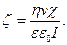 (6.14)
(6.14)
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 1093; Нарушение авторских прав?; Мы поможем в написании вашей работы!