
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Тема 6. Фізико-хімія дисперсних систем та розчинів високомолекулярних сполук 1 страница
|
|
|
|
Адсорбція на межі поділу тверде тіло-газ.Система тверде тіло-газ належить до нерухомих меж поділу фаз. Тверді тіла – адсорбенти при контакті з газовою фазою можуть поглинати своєю поверхнею молекули газів і парів. Такий процес називається сорбцією. У випадку коли процес сорбції відбувається тільки поверхнею твердого тіла, тобто сорбовані молекули не розподіляються по його об’єму, то таке явище називають адсорбцією. Речовину, яка адсорбується називають адсорбтивом.
Таблиця 5.4
Площі молекул для деяких гомологічних рядів і окремих сполук
| Гомологічний ряд | Полярна група | S.10-20, м2 |
| Аміди | -CONH2 | 20,5 |
| Жирні кислоти | -COOH | 20,5 |
| Спирти | -OH | 21,6 |
| Нітрили | -C=N | 27,7 |
| Холестерол | 40,8 | |
| Гемін | 70,0 | |
| Хлорофіл | 80-100 |
Взаємодія між частинками адсорбтиву і адсорбента може мати різний характер. Залежно від природи адсорбційних сил розрізняють два види адсорбції: фізичну та хімічну.
Хімічна адсорбція (хемосорбція) зумовлена хімічною взаємодією між поверхневими молекулами адсорбенту і адсорбтиву, яка приводить до утворення хімічних сполук з індивідуальними властивостями (адсорбат).
Фізична адсорбція відбувається на активних центрах поверхні адсорбенту (вузлах кристалічних решіток, гострих виступах), які володіють більшою надлишковою поверхневою енергією (рис.5.17).
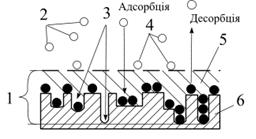
|
| Рис.5.17. Схема процеса адсорбції: 1 – адсорбат; 2 – газувата фаза; 3 – активні центри; 4 – адсорбтив; 5 – поверхнева плівка; 6 – адсорбент |
З часом частина адсорбованих молекул може відокремлюватися з поверхні адсорбенту. Такий процес, протилежний адсорбції, називається десорбцією.
На адсорбцію газів і пари речовин поверхнею твердого тіла впливають такі фактори:
1. Природа адсорбенту, його пористість. Пористість характеризується питомою поверхнею SПИТ – відношення поверхні поділу фаз S до одиниці маси дисперсної фази m:
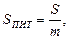 м2/кг. (5.21)
м2/кг. (5.21)
Значну частину SПИТ пористих адсорбентів складає площа капілярів і пор. В процесі адсорбції в них відбувається конденсація пари речовин у вигляді рідкої фази. Таке явище називається капілярною конденсацією. Прикладом пористого адсорбенту є активоване вугілля SПИТ якого складає 5.105 м2/кг.
2. Природа газу (пари речовин). Адсорбція газів і пари речовин залежить від критичної температури їх зрідження. Чим вона вища, тим краще відбувається адсорбція.
3. Тиск у газовій фазі над поверхнею твердого тіла. Згідно з рівнянням Генрі для ізотерми адсорбції величина адсорбції пропорційна тиску адсорбата в газовій фазі. Максимального граничного значення адсорбція досягає, коли вся поверхня адсорбційних центрів буде зайнята молекулами адсорбату й утвориться насичений мономолекулярний шар.
4. Температура. Її підвищення зменшує фізичну адсорбцію та підвищує десорбцію.
За теорією мономолекулярної адсорбції, яку запропонував американський вчений Ленгмюр, під час адсорбції концентрація адсорбату на поверхні збільшується і згідно з законом Фіка починається зворотній процес – дифузія. З часом швидкість цих процесів зрівнюється, наступає стан динамічної рівноваги – адсорбція L десорбція.
Виходячи з механізму адсорбції:
Молекули газу + Активний центр L Адсорбційний комплекс
(тиск Р) адсорбенту (Г)
(Гmax)
швидкість адсорбції молекул VАД пропорційна тиску Р і кількості вільних центрів Гmax – Г.
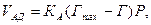 (5.22)
(5.22)
де КА – константа пропорційності.
Швидкість десорбції пропорційна числу зв’язаних у адсорбційний комплекс молекул:
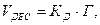 (5.23)
(5.23)
де КД – коефіцієнт пропорційності. Порівнявши вирази VАД=VДЕС одержимо рівняння ізотерми адсорбції Ленгмюра:
 (5.24)
(5.24)
де 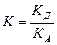 - відображає спорідненість молекул газу і адсорбату.
- відображає спорідненість молекул газу і адсорбату.
Загальний вигляд ізотерми адсорбції Ленгмюра зображений на рисунку 5.18. З рівняння Ленгмюра (5.24) випливає, що у випадку низьких значень тиску Р:
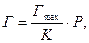
тобто поверхнева концентрація молекул газу (пари) Г прямо пропорційна тиску Р (на рис.5.18 початок кривої ізотерми). При високих значеннях тиску Р:
Г = Гmax ,
тобто кількість адсорбованих молекул дорівнює кількості активних центрів. При цьому адсорбція дорівнює граничному значенню Гmax (на рис.5.18 кінець кривої ізотерми).

|
| Рис.5.18. Ізотерма адсорбції Ленгмюра |
Адсорбція на межі поділу конденсованих фаз. Основні закономірності адсорбційних явищ на межі поділу конденсованих фаз в трикомпонентних системах розглянемо на характерному прикладі адсорбції органічних ПАР на межі поділу масло-вода. Під терміном „масло” рахується люба карбонгідрогенна фаза. Молекули органічних ПАР, які спроможні скомпенсувати різницю полярностей між водою і карбонгідрогенною фазою, орієнтуються полярною групою у воду, а карбонгідрогенним ланцюгом – в бік „масла” (рис.5.19), утворюючи перехідний шар, який вирівнює різницю полярностей між двома фазами.

|
| Рис.5.19. Схема адсорбції ПАР на межі поділу масло-вода |
Взаємна розчинність води і рідких або твердих карбонгідрогенів в цьому випадку нікчемна. В залежності від властивості розчинятися у водної і масляної фазах, що визначається будовою молекул, ПАР поділяють на водо- і маслорозчинні, а також ПАР проміжної природи, які розчинні як у водної, так і в масляної фазі.
У відповідності з правилом зрівнювання полярностей, найбільшим нахилом до адсорбції володіють речовини з полярністю, які мають проміжкові значення між полярностями контактуючих фаз. Так, на межі поділу між водним розчином ПАР і неполярним твердим тілом (парафін, сажа, вугілля, активоване вугілля) утворюються адсорбційні шари, в яких карбонгідрогенні ланцюги орієнтовані до поверхні твердої фази, а полярні групи занурені у воду (рис.5.20). До речі цим обумовлена миюча дія ПАР.
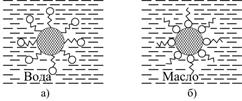
Рис.5.20. Орієнтація дифільних молекул ПАР в системі
конденсованих фаз: а – масло-вода; б – вода-масло
Навпаки, при занурюванні полярних твердих тіл або порошків-оксидів, карбонатів, силікатів, алюмосилікатів, крейди, глин і ін. – в масляну фазу, що містить малорозчинні ПАР, відбувається утворення адсорбційних шарів, в яких полярні групи розташовані у поверхні твердої фази, а карбонгідрогенні ланцюги „плавають” в масляному середовищі (рис.5.20, б). Цей процес має принципове значення при введенні полярних наповнювачів і пігментів у карбонгідрогену або малополярну полімерну фазу.
Суттєвою особливістю поверхні поділу тверде тіло-рідина є те, що речовина, яка адсорбується, може зв’язуватися з поверхнею не тільки слабкими „фізичними” силами, але і за рахунок утворення хімічних зв’язків з молекулами (йонами), які розташовані на поверхні твердої фази. Це явище яке називається хемосорбцією, може приводити до уявного недодержання правила зрівнювання полярностей. Так, на межі поділу полярного кристала (наприклад, силікату або сульфиду) і полярного середовища (води) адсорбція відбувається таким чином, що карбонгідрогенні радикали виявляються повернутими в бік води (рис.21, а).
При високих концентраціях хемосорбуючого ПАР, коли уся поверхня покрита моношаром, починається утворення протилежного орієнтованого другого шару, тобто „звичайна” адсорбція ПАР із водного розчину на неполярної поверхні (рис.5.21, б). Така здатність ПАР „намаслювати” частинки лежить в основі застосування ПАР для управління процесом флотаційного збагачення корисних копалин.
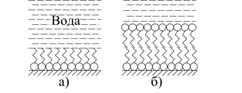
|
| Рис.5.21. Схема утворення адсорбційних шарів хемосорбуючими ПАР на поверхні полярної твердої фази: а – моношар; б – орієнтований подвійний шар |
Флотація – це розділення суміші мілких неоднорідних твердих частинок, яке побудовано на різній здатності змочування їх водою. При цьому частинки, що погано змочуються виносяться на поверхню рідини (спливають) разом з пухирцями повітря.
Розділення гідрофобних і гідрофільних частинок досягається за рахунок різного їх прилипання до поверхні поділу двох фаз, звичайно води (або водного розчину і повітря (газу).
При масляній флотації гідрофобні частинки виносяться із водної суспензії не пухирцями повітря, а краплинами масла (наприклад, керосину), що спливають.
Флотацією можна діставати тонко дисперсні осади, які завислі в рідкій фазі, або йони, що знаходяться в розчині і здатні хімічно з’єднуватися з ПАР, які адсорбуються на повітряних пухирцях і виносяться ними у пінний шар.
Прилипання твердої частинки до пухирця повітря – процес самодовільний, який йде зі зменшенням енергії Гіббса поверхні.
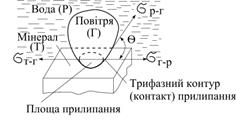
|
| Рис.5.22. Сили, які діють на трифазний периметр змочування |
На рис. 5.22 показані сили, що діють на трифазний периметр змочування. Умовою пінної флотації є наближене рівняння:
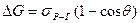 .
.
Крайовий кут 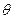 залежить від будови твердої речовини. Частинки, які мають гострі ребра і виступи, сильніше прилипають до пухирців, утримуються на них з більшою міцністю. Якщо на поверхні є нескомпенсовані сильні (йонні, ковалентні, металічні) зв’язки вона добре змочується водою. Якщо зв’язки слабкі (молекулярні) або компенсовані сильні, поверхня гідрофобна. Речовини з великими значеннями
залежить від будови твердої речовини. Частинки, які мають гострі ребра і виступи, сильніше прилипають до пухирців, утримуються на них з більшою міцністю. Якщо на поверхні є нескомпенсовані сильні (йонні, ковалентні, металічні) зв’язки вона добре змочується водою. Якщо зв’язки слабкі (молекулярні) або компенсовані сильні, поверхня гідрофобна. Речовини з великими значеннями 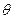 володіють значною флотацією. До них, наприклад, відноситься сірка, для якої
володіють значною флотацією. До них, наприклад, відноситься сірка, для якої 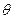 =85-880. Більшість неорганічних речовин при змочуванні водою мають невеликі крайові кути (табл. 5.5).
=85-880. Більшість неорганічних речовин при змочуванні водою мають невеликі крайові кути (табл. 5.5).
Таблиця 5.5
Кути змочування різних мінералів
| Мінерал | Градуси (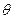 ) )
| Мінерал | Градуси (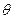 ) )
|
| CaSO4.2H2O | 11-16 | LiF2 | 41-45 |
| SiO2 | 21-26 | BaF2 | 41-44 |
| FeS2 | PbS | ||
| CaF2 | 34-45 | TiO2 | |
| CaCO3 | 35-45 | ZnS | 67-80 |
| BaSO4 | 37-46 |
Абсорбція з розчинів на межі між двома рідинами і рідини з твердим адсорбентом має важливе практичне значення в самих різних областях техніки, природних процесах і широко застосовуються в лабораторній практиці.
Полімолекулярна адсорбція. Теорія БЕТ. Відмінною рисою адсорбції пари є перехід до об’ємної конденсації при граничному тиску, який дорівнює тиску насиченої пари рідини Р=Р0. При цих умовах величина адсорбції пари рідин, що змочують тверде тіло, стає нескінченою. Тому, якщо в області заповнення моношару зріст адсорбції уповільнювався із збільшенням Р, тобто на ізотермі був опуклий відрізок, то при подальшому підвищенню тиску (при наближенні Р до Р0) зріст адсорбції з підвищенням тиску повинен збільшуватися. Адсорбційний шар при цьому стає товстішим і при Р=Р0, настає об’ємна конденсація. Таким чином, адсорбція стає полімолекулярною, а ізотерма проходить точку перегину (рис.5.23).
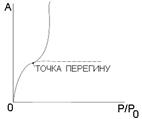
Рис.5.23. Ізотерма полімолекулярної адсорбції
Ізотерма адсорбції має S ‑подібний вигляд і цілком оборотна. Такий вигляд ізотерми свідчить про те, що після утворення мономолекулярного адсорбційного шару адсорбція продовжується. В точці перегину починає утворюватися другий шар. При цьому кожна молекула першого шару може бути активним центром для молекул, які утворюють другий шар і т.д. Процес полімолекулярної адсорбції на однорідній поверхні можна розглядати, як серію квазіхімічних реакцій утворення одиничних і кратних комплексів:
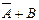 L
L 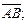
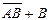 L
L 
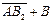 L
L 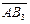 і т.д.
і т.д.
В результаті утворюється рівноважний адсорбційний шар, схема якого наведена на рисунку 5.24.
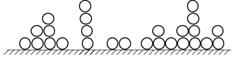
Рис.5.24. Схема рівноважного адсорбційного шару
С.Брунауер проаналізував ізотерми адсорбції і запропонував їх класифікацію на п’ять основних типів (рис.5.25).
Ізотерма типу І характерна для випадку мономолекулярної адсорбції. Ізотерми ІІ-V звичайно зв’язують з утворенням декількох адсорбційних шарів. Тип ізотерми II спостерігається для адсорбатів, молекули яких взаємодіють з поверхнею адсорбенту сильніше, ніж між собою. Якщо взаємодія між молекулами адсорбата перевищує, то адсорбція відбувається за типом III. У випадках II, III адсорбція збільшується нескінченно при наближенні до тиску насиченої пари Р0. Типи ізотерм IV і V також відповідають полімолекулярній адсорбції. Вони спостерігаються на адсорбентах з капілярно-пористою структурою. Характерним для цих ізотерм є граничне значення адсорбції при досягненні тиску насиченої пари Р0.

Рис.5.25. Адсорбційні ізотерми різних типів
Ці ізотерми описуються теорією полімолекулярної адсорбції БЕТ (Брунауер, Еммет, Теллер). Автори, зберігаючи адсорбційну теорію Ленгмюра, запропонували уніфіковану теорію фізичної адсорбції.
Виходячи з положень полімолекулярної теорії БЕТ на практиці для обробки експериментальних даних застосовують рівняння ізотерми полімолекулярної адсорбції А=f(p) у вигляді:
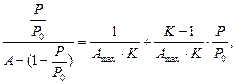 (5.25)
(5.25)
де А – адсорбційна ємність насиченого моношару, що визначається площею молекули газу, яку вона займає в насиченому моношарі; К – константа, що залежить від енергії взаємодії молекул в адсорбційному шарі; Р0 – тиск насиченої пари.
Експериментальні данні для адсорбції на твердих адсорбентах із газової фази в області середніх значень тиску пари Р адсорбуючого компоненту часто дуже добре описуються емпіричною ізотермою Фрейндліха:
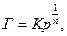 (5.26)
(5.26)
де К – питома адсорбція (залежить від природи адсорбенту та адсорбату); 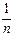 - емпіричний показник ступеня, необхідний для переводу рівняння в лінійну форму, що відображає ступінь кривизни ізотерми; Р – рівноважний тиск.
- емпіричний показник ступеня, необхідний для переводу рівняння в лінійну форму, що відображає ступінь кривизни ізотерми; Р – рівноважний тиск.
При р=1
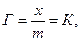
де х – кількість адсорбованої речовини (адсорбату); m – маса адсорбенту.
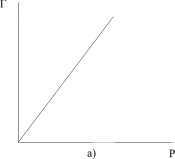
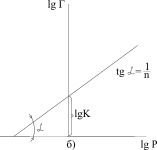
Ізотерма адсорбції Фрейндліха має вигляд (рис.5.26, а). Для визначення констант рівняння ізотерми Фрейндліха використовують логарифмічну форму рівняння Фрейндліха:
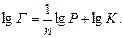
Сталі К та  визначають графічно (рис.5.26, б).
визначають графічно (рис.5.26, б).
| 
|
| Рис.5.26. Ізотерма адсорбції Фрейндліха (а) та графічне визначення констант рівняння (б) |
Поверхневі явища на межі поділу тверде тіло-рідина. В розчині молекули розчинника конкурують з молекулами розчиненої речовини за адсорбційні центри на поверхні твердого тіла, що ускладнює процес адсорбції і зменшує швидкість встановлення адсорбційної рівноваги.
На адсорбцію розчинів дуже впливає хімічна природа адсорбенту, адсорбату і розчинника. Залежність величини адсорбції від рівноважної концентрації речовини описується такими самими рівняннями, що і для меж поділу рідина-газ і тверде тіло-газ. Величину адсорбції звичайно визначають за різницею концентрацій розчиненої речовини до (С0) і після (С) адсорбції:
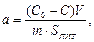 (5.26)
(5.26)
де V – об’єм розчину, з якого відбувається адсорбція; SПИТ – питома поверхня адсорбенту (м2/кг); m – наважка адсорбенту.
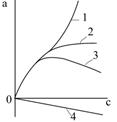
Адсорбція розчинника зумовлює відхилення ізотерми адсорбції від їх звичайного вигляду (рис.5.27). Так, ізотерми 1 і 2 описують полімолекулярну і мономолекулярну адсорбції відповідно. Уявне зменшення адсорбованої речовини при значній її концентрації в розчині пов’язане з поглинанням молекул розчинника поверхнею адсорбенту (ізотерма 3). У випадку коли розчинник поглинається набагато краще, ніж розчинна речовина ізотерма адсорбції (4) набуває вигляду „від’ємної” адсорбції, тобто формальний розрахунок за рівнянням адсорції дає від’ємну величину адсорбції.
|
| Рис.5.27. Ізотерми адсорбції розчинених речовин на поверхні твердого тіла: 1 – полімолекулярна адсорбція; 2 – мономолекулярна адсорбція; 3– адсорбція з поглинанням молекул розчинника поверхнею адсорбенту; 4 – „від’ємна” адсорбція |
Згідно правила вирівнювання полярностей Ребіндера на поверхні поділу фаз з різними полярностями може адсорбуватися в першу чергу тільки речовина з проміжною полярністю. Адсорбція розчиненої речовини відбувається, якщо виконується співвідношення:
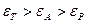
| або | 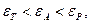
|
де 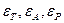 - діелектрична проникність адсорбенту, розчиненої речовини, розчинника відповідно.
- діелектрична проникність адсорбенту, розчиненої речовини, розчинника відповідно.
У відповідності до правила Ребіндера адсорбція з водних розчинів органічних ПАР на твердих адсорбентах, таких як активоване вугілля і кремнезем (силікагель), відбувається з урахуванням такої послідовності:
вугілля < дифільна органічна речовина < вода < кремнезем.
Тому якщо потрібно видалити ПАР з органічних розчинників, треба застосувати кремнезем, а з водних розчинів – вугілля.
Підвищення розчинності органічних ПАР у водному розчині при збільшенні молекулярної маси дифільних молекул (одного і того самого гомологічного ряду) приводить до отримання правила, зворотного до правила Дюкло-Траубе, тобто збільшення довжини ланцюга на кожну групу – СН2 приводить до зменшення адсорбції ПАР. Це пов’язано з тим, що великі молекули адсорбату не можуть проникнути в тонкі пори і капіляри адсорбенту, тому адсорбційна рівновага встановлюється дуже повільно. З метою її прискорення систему струшують або ретельно перемішують.
Характерною особливістю адсорбції молекул полімерів на твердих тілах в розчині є зміна конформаційного стану макромолекул. Досить довгі і гнучкі молекули полімерів, які перебувають в розчині у вигляді клубків (глобул), розгортаються, утворюючи дуги і петлі на поверхні твердого тіла. Ланками цих утворень відбувається безпосередній контакт (адсорбція) з поверхнею твердого тіла (рис.5.28).
Адсорбція на поверхні твердого тіла істотно відрізняється для неелектролітів, коли адсорбуються молекули розчиненої речовини і для електролітів, коли адсорбуються йони.
Згідно з правилом Панета-Фаянса на поверхні твердого тіла адсорбуються лише йони, здатні добудовувати решітку, тобто йони, які входять до складу кристалічної решітки твердого тіла або ізоморфні їм.

|
| Рис.5.28. Будова адсорбційного шару полімеру на поверхні твердого тіла |
Йони електроліту можуть адсорбуватись з різною інтенсивністю і за різними механізмами, причому на їх адсорбцію значною мірою впливають заряд поверхні, геометричні параметри йонів адсорбента і адсорбата, наявність на поверхні раніше адсорбованих йонів тощо.
Здатність йонів до адсорбції залежить від їх природи. За порядком послідовного зростання здатності адсорбуватися катіони і аніони можна розмістити в ряди, які називають ліотропними.
Катіони:
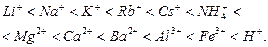
Аніони:
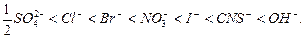
Слід відзначити, що порядок розміщення йонів у ліотропних рядах за збільшенням здатності до адсорбції зберігається з розміщенням їх за зменшенням здатності до гідратації.
Якщо адсорбент, на поверхні якого є адсорбовані йони, помістити в розчин іншого електроліту, то між ними відбувається йонний обмін:
[Адсорбент]n- . n[H+] + mCa2+ + 2 mCl- L
L [Адсорбент]n-1 . (n-x)[H+];
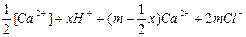
або
[Адсорбент]n+ . n[Cl-] + 2mNa+ + mSO42- L
L [Адсорбент]n+ . (n-y)[Cl-]

Йонний обмін є оборотним, він описується рівнянням Нікольського:
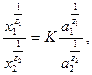 (5.27)
(5.27)
де х1 і х2 – вміст обмінних йонів адсорбенту; а1 і а2 – активності (концентрації) тих самих йонів в розчині; z1 і z2 - заряди обмінних йонів; К – константа йонного обміну (залежить від хімічної природи йонів, їх радіусів, гідратації тощо).
Максимальна кількість йонів адсорбентів (катіонів і аніонів), що здатні обмінюватись з йонами розчину, називається ємністю обміну. Ємність штучних іонообмінних смол може складати до 5-10 ммоль/г.
Різна адсорбційна здатність речовин дає змогу застосувати адсорбцію для аналізу сумішей і розділення компонентів сорбцій ними методами.
Розділення компонентів здійснюють пропусканням суміші крізь хроматографічну колонку з зернами адсорбента (рис. 5.29).
З суміші насамперед адсорбуються молекули, що краще адсорбуються (більш активної речовини 3) заповнюючи шар 1. В розчині, що рухається нижче, концентрація компонента 3 надзвичайно мала і на зернах шару абсорбента ІІ адсорбується наступний за адсорбційною здатністю компонент 2. В наступному шарі ІІІ адсорбується компонент 1, який за адсорбційною здатністю поступається компоненту 2. Якщо в суміші буде наявність четвертого компонента з найгіршою адсорбційною здатністю, то він адсорбуючись, заповнює шар адсорбента IV тощо, а з колонки витікає чистий розчинник.

|
| Рис.5.29. Схема хроматографічної колонки |
При подальшому пропусканні розчину крізь хроматографічну колонку відбувається “проскок”, тобто на виході виявляються розчинені компоненти. Першим на виході з колонки виявляється компонент 1, який адсорбується найгірше від усіх інших, потім суміш 1+2 компонентів, а після них суміш 1+2+3 компонентів, тощо (рис.5.30).
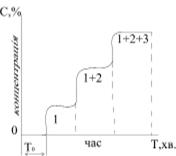
|
Рис.5.30. Вихідна крива при фронтальній хроматографії
(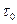 - тривалість „проскоку”, 1,2,3 – компоненти) - тривалість „проскоку”, 1,2,3 – компоненти)
|
Подібне розділення компонентів вперше здійснив у 1904 р. М.С.Цвет. Цей процес він назвав хроматографією.
Розглянуте вище часткове розділення суміші називається фронтальною хроматографією. Для повного розділення компонентів суміші використовують елюєнтну або витискувальну хроматографію, яка полягає в тому, що при промиванні колонки чистим розчинником адсорбовані компоненти послідовно видаляються з неї. При цьому, насамперед, вимиваються молекули компонента 1, який адсорбується найгірше, потім 2 і т.д.
Фронтальна і витискувальна хроматографії відносяться до рідинної адсорбційної хроматографії.
Спеціальним видом рідинної хроматографії є хроматографія на папері з чистої целюлози. Досліджувані водні розчини у вигляді крапель наносять на смужку паперу на деякій відстані від краю. Після випаровування розчинника край паперової стрічки поміщають у камеру з рухомою фазою (розчинником). При капілярному переміщенні розчинника вздовж смужки паперу вихідна пляма переміщується за розчинником. Під час руху вона розділяється на окремі плями (внаслідок адсорбційної здатності – компоненти, що найгірше адсорбуються пересуваються швидше). Через деякий час папір висушують розчином індикатора для виявлення плям. Застосовують також нагрівання паперу, оприскування розчинами кислот, опромінювання УФ-світлом та ін.
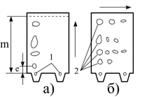
|
| Рис.5.31. Двомірна хроматограма: а – первинне розділення; б – розділення в перпендикулярному напрямку; 1,2 – точки лінії старту; l – відстань, яку пройшла пляма; m – відстань, яку пройшов фронт проявника |
Варіантами паперової хроматографії є двомірна та радіальна хроматографії. При двомірній хроматографії плями, що утворилися після першого розділення (рис. 5.31, а) піддаються розділенню іншою рухомою фазою у напрямку, перпендикулярному до першого ряду плям (рис. 5.31, б).
Для ідентифікації речовин використовують величину Rf, яка є відношенням:
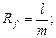
Нижче приведені значення Rf для деяких йонів.
| Ка-ті-он | Ni2+ | Al3+ | Co3+ | Pb2+ | Cu2+ | Zn2+ | Cd2+ | Bi3+ | Fe3+ |
| Rf | 0,13 | 0,15 | 0,54 | 0,70 | 0,77 | 0,94 | 0,1 | 0,1 | 0,1 |
Слід зауважити, що величина Rf залежить від якості паперу і не може бути раз і назавжди встановлена для будь якої речовини. Головна вимога до якості паперу – однорідність і ізотропність структури.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 1337; Нарушение авторских прав?; Мы поможем в написании вашей работы!