
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
VI.1 Модель будови атома. Постулати Бора
|
|
|
|
Нагадаємо, що атом є найменша частинка хімічного елемента (хімічно простої речовини), яка визначає всі її хімічні та фізичні властивості. Принципова будова атомів будьяких хімічних елементів однакова. Атоми усіх елементів складаються з трьох типів елементарних частинок – позитивних протонів, нейтральних нейтронів та негативних електронів. Атоми різних елементів різняться між собою тільки за кількістю елементарних частинок, що входять до складу їх атомів.
Експериментальні та теоретичні дослідження властивостей речовин, виконані в кінці XIX та на початку XX ст. такими видатними вченими, як Дж. Томпсон, Е. Резерфорд, Н. Бор та іншими, привели до висновку, що атом будь-якого хімічного елемента складається із центральної позитивно зарядженої частини – ядра, до складу якого входять протони та нейтрони, і в якому сконцентрована практично вся маса атома, навколо якого рухаються негативно заряджені частинки – електрони. Така будова атома подібна структурі сонячної системи, тому її назвали планетарною.
Діаметр атомів приблизно дорівнює 10-10 м, діаметр ядер атомів – 10-15 м. У нормальному стані в атомі кількість електронів на орбітах і протонів в ядрі однакова, а оскільки за величиною заряд протона qp дорівнює заряду електрона qe (qp = qe = 1,6 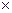 10-19 Кл), то атоми електронейтральні. Основна маса атома сконцентрована в ядрі, тому що протони і нейтрони значно переважають електрони за масою (майже у 2 тис. разів), причому маса протона і нейтрона приблизно однакові.
10-19 Кл), то атоми електронейтральні. Основна маса атома сконцентрована в ядрі, тому що протони і нейтрони значно переважають електрони за масою (майже у 2 тис. разів), причому маса протона і нейтрона приблизно однакові.
В основі сучасної моделі атома лежать три постулати Н. Бора:
1. Електрони в атомі рухаються не по будь-яких орбітах, а тільки по орбітах певних радіусів, які називаються стаціонарними.
2. Рухаючись по стаціонарних орбітах, електрони не випромінюють і не поглинають енергії.
3. При переході електронів з вищих орбіт на нижчі, атоми випромінюють, а при зворотних переходах – поглинають енергію.
Кількість стаціонарних орбіт, по яких рухаються в атомі електрони, нескінченно велика, але в нормальному (не збудженому) стані в атомі заповнені тільки нижчі орбіти.
Найбільш простим хімічним елементом є водень. До складу його атома входять один протон і один електрон, що рухається по найближчій до ядра орбіті (рис. VI.1).
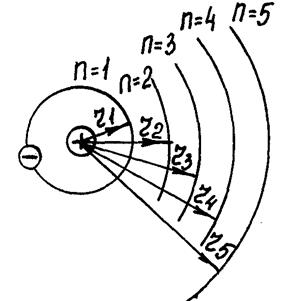
Рис. VІ.1
VI.2 Будова багатоелектронних атомів.
Таблиця Менделєєва
Для побудови моделі будь-якого багатоелектронного атома користуються формулою, отриманою в одній із сучасних теоретичних наук – квантовій механіці.
Максимальна кількість m електронів, що може бути на n-тій орбіті (n=1,2,3,...), прямо пропорційна квадрату номера орбіти.
m = 2 n2 . (VI.1)
Отже: максимальна кількість електронів на першій від ядра орбіті – m = 2 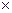 12 = 2, на другій – m = 2
12 = 2, на другій – m = 2 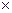 22 = 8, на третій – m = 2
22 = 8, на третій – m = 2 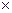 32 = 18 і т. д.
32 = 18 і т. д.
Як відомо, всі хімічні елементи, залежно від їх маси і хімічних властивостей, Д.І. Менделєєв розмістив у вигляді певного виду таблиці, де хімічні елементи розміщені один за одним у міру зростання їх атомної маси у вигляді рядів (періодів) і стовпчиків (груп) таким чином, що хімічні властивості елементів у кожному стовпчику (групі) подібні між собою. Сучасна фізика пояснює періодичну системи хімічних елементів так:
1) Порядковий номер хімічного елемента в таблиці Менделєєва дорівнює кількості електронів в його атомі (кількості протонів в ядрі атома).
2) Номер періоду (рядка) дорівнює кількості електронних орбіт атома, що заповнюються електронами.
3) Номер групи (стовпчика) дорівнює кількості електронів на останній орбіті, що заповнюється електронами.
Важливою характеристикою хімічних елементів є їх валентність.
Валентністю називають кількість електронів, яку атом хімічного елемента віддає чи приймає при хімічних реакціях з атомами інших елементів.
При обміні електронами атоми віддають чи приймають електрони таким чином, щоб остання електронна орбіта була повністю заповненою.
Як приклад, побудуємо модель багатоелектронного атома, що стоїть в таблиці Менделєєва під номером N = 11 (рис.VI.2).
 Він стоїть одинадцятим тому, що в ядрі його атома знаходиться 11 протонів, а на орбітах – 11 електронів. На першій орбіті – 2 електрони, на другій – 8, а на третій – 1. Цей елемент знаходиться у третьому періоді, тому що заповнюється електронами 3 орбіти, у першій групі, окільки на останній орбіті один електрон. При хімічних реакціях атом віддає один електрон, Рис. VІ.2
Він стоїть одинадцятим тому, що в ядрі його атома знаходиться 11 протонів, а на орбітах – 11 електронів. На першій орбіті – 2 електрони, на другій – 8, а на третій – 1. Цей елемент знаходиться у третьому періоді, тому що заповнюється електронами 3 орбіти, у першій групі, окільки на останній орбіті один електрон. При хімічних реакціях атом віддає один електрон, Рис. VІ.2
тобто хімічний елемент одновалентний.
Таким же чином можна побудувати модель атома будь-якого хімічного елемента та визначити його валентність, якщо відомий порядковий номер елемента в періодичній системі Менделєєва.
VI.3 Утворення спектрів випромінювання і поглинання електромагнітних хвиль
 В атомі кожного хімічного елемента значення енергії електрона на кожній із стаціонарних орбіт абсолютно певне і не таке як в атомах інших хімічних елементів. Відповідно й різниця енергії між стаціонарними енергетичними рівнями електронів в атомах різних хімічних елементів різна, але певна для кожного хіміч- Рис. VI.3
В атомі кожного хімічного елемента значення енергії електрона на кожній із стаціонарних орбіт абсолютно певне і не таке як в атомах інших хімічних елементів. Відповідно й різниця енергії між стаціонарними енергетичними рівнями електронів в атомах різних хімічних елементів різна, але певна для кожного хіміч- Рис. VI.3
ного елемента.
При поглинанні (випромінюванні) електромагнітних хвиль їх енергія (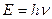 ) дорівнює різниці між значеннями енергії Wi і Wn енергетичних рівнів, між якими відбувається перехід електрона (Wi – енергія рівня, з якого переходить, а Wn – енергія рівня на який переходить електрон) (рис. VI.3).
) дорівнює різниці між значеннями енергії Wi і Wn енергетичних рівнів, між якими відбувається перехід електрона (Wi – енергія рівня, з якого переходить, а Wn – енергія рівня на який переходить електрон) (рис. VI.3).
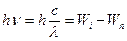 . (VI.2)
. (VI.2)
Оскільки різниця Wi – Wn в атомі хімічного елемента певні, то він випромінює (поглинає) електромагнітні хвилі тільки з певними частотами 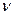 (довжинами хвиль
(довжинами хвиль 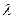 ). Тому, визначаючи спектр випромінювання чи поглинання тіла, можна встановити, із атомів яких хімічних елементів воно складається, а за інтенсивністю випроміню-вання (поглинання) – про їх кількість.
). Тому, визначаючи спектр випромінювання чи поглинання тіла, можна встановити, із атомів яких хімічних елементів воно складається, а за інтенсивністю випроміню-вання (поглинання) – про їх кількість.
Визначення спектрів випромінювання (поглинання) лежить в основі спектрального аналізу хімічного складу речовин. Для цього використовують спектрометри і спектрографи різних конструкцій.
|
|
|
|
|
Дата добавления: 2015-05-23; Просмотров: 1390; Нарушение авторских прав?; Мы поможем в написании вашей работы!