
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Необоротні і оборотні реакції
|
|
|
|
Всі хімічні реакції можна поділити на дві групи: необоротні і оборотні. Необоротні реакції проходять до кінця, а оборотні - не до кінця, тому що вони можуть відбуватись як в прямому, так і в зворотному напрямку. Розглянемо два приклади:
1.  .
.
При достатній кількості H2SO4 реакція закінчиться, коли весь цинк прореагує. Це необоротна реакція.
2.  L
L 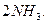
Якщо проаналізувати цю систему через деякий час, то в системі буде присутній не тільки продукт реакції (амоніак), але і вихідні речовини (азот і водень). Це оборотна реакція.
Реакцію, яка відбувається зліва направо, називають прямою, а справа наліво - зворотною.
Розглянемо її на прикладі утворення гідрогенйодиду:
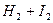 L
L 

Рис. 22. Зміна швидкості прямої (v1) і зворотної (v2) реакцій з часом
Швидкість прямої і зворотної реакції виражається рівняннями:
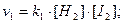
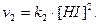
При рівновазі V1 = V2, звідки

 .
.
Відношення констант швидкості прямої і зворотної реакцій також є константою:

Звідси  .
.
К - константа рівноваги, стала величина при сталій температурі.
Рівняння константи рівноваги показує, що в умовах рівноваги концентрації всіх речовин, які беруть участь в реакції, зв’язані між собою. Зміна концентрації будь-якої з цих речовин спричиняє зміну концентрацій усіх інших речовин. В результаті встановлюються нові концентрації, але співвідношення між ними знову відповідає константі рівноваги.
У випадку гетерогенних реакцій у вираз константи рівноваги входять концентрації тільки тих речовин, які знаходяться в газовій або рідкій фазі. Наприклад, для реакції: СО2+С L 2СО, константа рівноваги має вигляд:
 .
.
Константа рівноваги залежить від природи реагуючих речовин і від температури. Від наявності каталізатора вона не залежить. Оскільки каталізатор змінює енергію активації і прямої, і зворотної реакцій на ту саму величину, то на відношення констант їх швидкості він не впливає. Він може лише прискорити встановлення рівноваги.
|
|
|
|
|
Дата добавления: 2015-05-24; Просмотров: 1037; Нарушение авторских прав?; Мы поможем в написании вашей работы!